العمل الديناميكي الدوائي مثبطات إيسيرتبط بحجب إنزيم ACE ، الذي يحول أنجيوتنسين 1 إلى أنجيوتنسين 2 في الدم والأنسجة ، مما يؤدي إلى القضاء على الضغط والتأثيرات العصبية العصبية الأخرى لـ ATII ، كما يمنع تعطيل البراديكينين ، مما يعزز تأثير توسع الأوعية.
معظم مثبطات الإنزيم المحول للأنجيوتنسين هي عقاقير أولية (باستثناء كابتوبريل ، ليزينوبريل) ، يتم تنفيذ تأثيرها بواسطة المستقلبات النشطة. تختلف مثبطات الإنزيم المحول للأنجيوتنسين في تقاربها مع الإنزيم المحول للأنجيوتنسين ، وتأثيرها على RAAS في الأنسجة ، والتهاب الدهون ، ومسارات التخلص.
التأثير الديناميكي الدوائي الرئيسي هو الدورة الدموية ، المرتبط بتوسع الأوعية الشرياني الوريدي المحيطي ، والذي ، على عكس موسعات الأوعية الأخرى ، لا يترافق مع زيادة في معدل ضربات القلب بسبب انخفاض نشاط SAS. ترتبط التأثيرات الكلوية لمثبطات الإنزيم المحول للأنجيوتنسين بتوسع الشرايين الكبيبية وزيادة التبول اللاإرادي واحتباس البوتاسيوم نتيجة لانخفاض إفراز الألدوستيرون.
إن التأثيرات الديناميكية الدموية لمثبطات الإنزيم المحول للأنجيوتنسين تكمن وراء تأثيرها الخافض للضغط ؛ في مرضى قصور القلب الاحتقاني - في تقليل توسع القلب وزيادته القلب الناتج.
مثبطات الإنزيم المحول للأنجيوتنسين لها تأثير عضوي (القلب والأوعية الدموية والكلى) ؛ يؤثر بشكل إيجابي على استقلاب الكربوهيدرات (يقلل من مقاومة الأنسولين) و التمثيل الغذائي للدهون(زيادة مستويات HDL).
تستخدم مثبطات الإنزيم المحول للأنجيوتنسين في العلاج ارتفاع ضغط الدم الشرياني، ضعف البطين الأيسر وفشل القلب ، وتستخدم في احتشاء حادعضلة القلب ، داء السكري ، اعتلال الكلية والبروتينية.
فئة محددة آثار جانبية- سعال ، انخفاض ضغط الدم من الجرعة الأولى ، وذمة وعائية ، آزوتيميا.
الكلمات الدالة: أنجيوتنسين 2 ، مثبطات الإنزيم المحول للأنجيوتنسين ، تأثير خافض للضغط ، تأثير وقائي عضوي ، تأثير وقائي للقلب ، تأثير وقائي للكلى ، ديناميكيات دوائية ، حركية دوائية ، آثار جانبية ، تفاعلات دوائية.
هيكل ووظائف نظام رينين أنجيوتنسينالدوستيرون
نظام الرينين-أنجيوتنسين-الألدوستيرون (RAAS) له تأثير خلطي مهم على نظام القلب والأوعية الدموية ويشارك في تنظيم ضغط الدم. الرابط المركزي لـ RAAS هو أنجيوتنسين 2 (AT11) (مخطط 1) ، الذي له تأثير قوي مباشر على تضيق الأوعية بشكل رئيسي على الشرايين وتأثير وسيط على الجهاز العصبي المركزي ، وإطلاق الكاتيكولامينات من الغدد الكظرية ويسبب زيادة في مقاومة الأوعية الدموية الطرفية الكلية ، يحفز إفراز الألدوستيرون ويؤدي إلى احتباس السوائل وزيادة في BCC) ، ويحفز إطلاق الكاتيكولامينات (النوربينفرين) والهرمونات العصبية الأخرى من النهايات المتعاطفة. يرجع تأثير AT11 على مستوى ضغط الدم إلى التأثير على قوة الأوعية الدموية ، وكذلك من خلال إعادة الهيكلة الهيكلية وإعادة تشكيل القلب والأوعية الدموية (الجدول 6.1). على وجه الخصوص ، ATII هو أيضًا عامل نمو (أو معدل نمو) لخلايا عضلة القلب وخلايا العضلات الملساء الوعائية.
مخطط 1.هيكل نظام الرينين - أنجيوتنسين - الألدوستيرون
وظائف الأشكال الأخرى للأنجيوتنسين.أنجيوتنسين 1 ليس له أهمية تذكر في نظام RAAS ، حيث يتحول بسرعة إلى ATP ، بالإضافة إلى أن نشاطه يقل 100 مرة عن نشاط ATP. يعمل أنجيوتنسين 3 مثل ATP ، لكن نشاطه الضاغط أضعف بأربع مرات من ATP. يتكون أنجيوتنسين 1-7 نتيجة تحويل الأنجيوتنسين 1. من حيث الوظائف ، يختلف اختلافًا كبيرًا عن ATP: فهو لا يسبب تأثيرًا ضاغطًا ، ولكن على العكس من ذلك ، يؤدي إلى انخفاض في ضغط الدم بسبب إفراز هرمون ADH ، وتحفيز تخليق البروستاجلاندين ، وتبول ناتري.
RAAS له تأثير تنظيمي على وظيفة الكلى. يسبب ATP تشنجًا قويًا للشريان الوارد وانخفاض الضغط في الشعيرات الدموية في الكبيبة ، وانخفاض في الترشيح في النيفرون. نتيجة لانخفاض الترشيح ، ينخفض إعادة امتصاص الصوديوم في النيفرون القريب ، مما يؤدي إلى زيادة تركيز الصوديوم في الأنابيب البعيدة وتنشيط مستقبلات الصوديوم الحساسة في تعداد البقعة في النيفرون. عن طريق الفراء-
الأعضاء والأنسجة | تأثيرات |
تضيق الأوعية (إطلاق HA ، vasopressin ، endothelin-I) ، لا تعطيل ، قمع tPA |
|
مؤثر في التقلص العضلي والتأثير الزمني تشنج الشرايين التاجية |
|
تشنج الأوعية الكلوية (الشرايين الأكثر انتشارًا) تقلص وتكاثر الخلايا ميسانجيل إعادة امتصاص الصوديوم وإفراز البوتاسيوم انخفاض في إفراز الرينين |
|
الغدد الكظرية | إفراز الألدوستيرون والأدرينالين |
مخ | إفراز الفازوبريسين ، الهرمون المضاد لإدرار البول ، تفعيل SNS ، تحفيز مركز العطش |
الصفائح | تحفيز الالتصاق والتجمع |
اشتعال | تفعيل وترحيل الضامة التعبير عن الالتصاق ، الانجذاب الكيميائي ، والعوامل السامة للخلايا |
العوامل الغذائية | تضخم الخلايا العضلية القلبية ، الخلايا الجذعية الصغيرة للأوعية الدموية ، تحفيز الجينات الأولية ، عوامل النمو ، زيادة تخليق مكونات المصفوفة خارج الخلية والبروتينات المعدنية |
nism تعليقويصاحب ذلك تثبيط إطلاق الرينين وزيادة معدل الترشيح الكبيبي.
يرتبط عمل RAAS بالألدوستيرون ومن خلال آلية التغذية الراجعة. الألدوستيرون هو أهم منظم لحجم السائل خارج الخلية وتوازن البوتاسيوم. فعل مباشرلا يؤثر الألدوستيرون على إفراز الرينين و ATP ، ولكن من الممكن حدوث تأثير غير مباشر من خلال احتباس الصوديوم في الجسم. يشارك ATP والإلكتروليتات في تنظيم إفراز الألدوستيرون ، مع تحفيز ATP ، ويقلل الصوديوم والبوتاسيوم من تكوينه.
يرتبط توازن الكهارل ارتباطًا وثيقًا بنشاط RAAS. لا يؤثر الصوديوم والبوتاسيوم على نشاط الرينين فحسب ، بل يغيران أيضًا حساسية الأنسجة لـ ATP. في نفس الوقت ، في تنظيم النشاط
يلعب الرينين والصوديوم دورًا كبيرًا ، وفي تنظيم إفراز الألدوستيرون ، يكون للبوتاسيوم والصوديوم نفس التأثير.
لوحظ التنشيط الفسيولوجي لـ RAAS مع فقدان الصوديوم والسوائل ، وانخفاض كبير في ضغط الدم ، مصحوبًا بانخفاض ضغط الترشيح في الكلى ، وزيادة نشاط الجهاز السمبثاوي الجهاز العصبي، وكذلك تحت تأثير العديد من العوامل الخلطية (الفازوبريسين ، الهرمون الأذيني المدر للصوديوم ، الهرمون المضاد لإدرار البول).
خط كامل أمراض القلب والأوعية الدمويةقد يساهم في التحفيز المرضي لـ RAAS ، على وجه الخصوص ، في ارتفاع ضغط الدم ، وفشل القلب الاحتقاني ، واحتشاء عضلة القلب الحاد.
من المعروف الآن أن RAS لا يعمل فقط في البلازما (وظيفة الغدد الصماء) ، ولكن أيضًا في العديد من الأنسجة (الدماغ وجدار الأوعية الدموية والقلب والكلى والغدد الكظرية والرئتين). يمكن أن تعمل أنظمة الأنسجة هذه بشكل مستقل عن البلازما المستوى الخلوي(تنظيم paracrine). لذلك ، هناك تأثيرات قصيرة المدى لـ ATII ، بسبب جزءه المنتشر بحرية في الدورة الدموية الجهازية ، والتأثيرات المتأخرة ، التي يتم تنظيمها من خلال الأنسجة RAS وتؤثر على آليات التكيف الهيكلي لتلف الأعضاء (الجدول 6.2).
الجدول 6.2
الكسور المختلفة من RAAS وتأثيراتها
الإنزيم الرئيسي لـ RAAS هو الإنزيم المحول للأنجيوتنسين (ACE) ، والذي يضمن تحويل ΑTI إلى ATII. الكمية الرئيسية من ACE موجودة في الدوران الجهازي ، مما يوفر تشكيل ATII المتداول والتأثيرات الجيوديناميكية قصيرة المدى. يمكن إجراء تحويل AT إلى ATII في الأنسجة ليس فقط بمساعدة ACE ، ولكن أيضًا باستخدام إنزيمات أخرى.
تامي (chymases ، endoperoxides ، cathepsin G ، إلخ) ؛ يعتقدون أنهم يلعبون دورًا رائدًا في عمل الأنسجة RAS وتطوير التأثيرات طويلة المدى لنمذجة وظيفة وهيكل الأعضاء المستهدفة.
إن الإنزيم المحول للأنجيوتنسين مطابق لإنزيم كينيناز II المتورط في تحلل البراديكينين (المخطط 1). براديكينين هو موسع وعائي قوي يشارك في تنظيم دوران الأوعية الدقيقة ونقل الأيونات. براديكينين لديه جدا فترة قصيرةالحياة وموجودة في مجرى الدم (الأنسجة) بتركيزات منخفضة ؛ لذلك ستظهر آثاره كهرمون محلي (باراكرين). يعزز Bradykinin زيادة في Ca 2 + داخل الخلايا ، وهو عامل مساعد لـ NO synthetase تشارك في تكوين عامل استرخاء البطانة (أكسيد النيتريك أو NO). عامل استرخاء البطانة ، الذي يمنع تقلص العضلات الوعائية وتجمع الصفائح الدموية ، هو أيضًا مثبط للانقسام وتكاثر العضلات الملساء الوعائية ، مما يوفر تأثيرًا مضادًا لتصلب الشرايين. كما يحفز براديكينين تخليق PGE في بطانة الأوعية الدموية. 2 و PGI 2 (البروستاسكلين) - موسعات وعائية قوية وعوامل مضادة للصفيحات الدموية.
وبالتالي ، فإن البراديكينين ونظام الأقارب بأكمله مضادان لـ RAAS. يحتمل أن يؤدي منع الإنزيم المحول للأنجيوتنسين إلى زيادة مستوى الأقارب في أنسجة القلب وجدار الأوعية الدموية ، مما يوفر تأثيرات مضادة للتكاثر ، ومضادة للاكتئاب ، ومضادة للتطور ، ومضادة للصفيحات. يساهم الكينين في زيادة تدفق الدم وإدرار البول وإدرار البول دون حدوث تغيير كبير في معدل الترشيح الكبيبي. PG E. 2 و PGI 2 كما أن لها تأثيرات مدر للبول ومدر للبول وتزيد من تدفق الدم الكلوي.
الإنزيم الرئيسي لـ RAAS هو الإنزيم المحول للأنجيوتنسين (ACE) ، والذي يوفر تحويل ATI إلى ATII ، ويشارك أيضًا في تحلل البراديكينين.
آلية العمل والصيدلة لمثبطات الإنزيم المحول للأنجيوتنسين
ترتبط التأثيرات الديناميكية الدوائية لمثبطات الإنزيم المحول للأنجيوتنسين بحجب ACE وانخفاض في تكوين المنشطات الأمفيتامينية في الدم والأنسجة ،
القضاء على الضغط والتأثيرات العصبية الأخرى. في الوقت نفسه ، وفقًا لآلية التغذية المرتدة ، يمكن أن يرتفع مستوى الرينين البلازمي و ATI ، بالإضافة إلى انخفاض عابر في مستوى الألدوستيرون. تمنع مثبطات الإنزيم المحول للأنجيوتنسين تدمير البراديكينين ، مما يكمل ويعزز تأثير توسع الأوعية.
هناك العديد من مثبطات الإنزيم المحول للأنجيوتنسين والعديد من الخصائص المهمة التي تميز الأدوية في هذه المجموعة (الجدول 6.3):
1) التركيب الكيميائي(وجود مجموعة Sff ، مجموعة الكربوكسيل ، المحتوية على الفوسفور) ؛
2) نشاط الدواء (دواءأو دواء مساعد) ؛
3) التأثير على الأنسجة RAAS.
4) خصائص الحرائك الدوائية (محبة الدهون).
الجدول 6.3
توصيف مثبطات الإنزيم المحول للأنجيوتنسين
الاستعدادات | المجموعة الكيميائية | النشاط الطبي | التأثير على الأنسجة RAAS |
كابتوبريل | الدواء | ||
إنالابريل | كربوكسي- | عقاقير أولية | |
بينظبرريل | كربوكسي- | عقاقير أولية | |
كوينابريل | كربوكسي- | عقاقير أولية | |
يسينوبريل | كربوكسي- | الدواء | |
موكسيبريل | كربوكسي- | عقاقير أولية | |
بيريندوبريل | كربوكسي- | عقاقير أولية | |
راميبريل | كربوكسي- | عقاقير أولية | |
تراندولابريل | كربوكسي- | عقاقير أولية | |
فوسينوبريل | عقاقير أولية | ||
سيلازابريل | كربوكسي- | عقاقير أولية |
تعتمد طبيعة التوزيع في الأنسجة (خصوصية الأنسجة) لمثبطات الإنزيم المحول للأنجيوتنسين على درجة محبة الدهون ، والتي تحدد الاختراق في الأنسجة المختلفة ، وعلى قوة الارتباط بالنسيج ACE. تمت دراسة الفاعلية النسبية (التقارب) لمثبطات الإنزيم المحول للأنجيوتنسين في المختبر.يتم عرض البيانات حول الفاعلية المقارنة لمثبطات الإنزيم المحول للأنجيوتنسين المختلفة أدناه:
Quinaprilat = Benazeprilat = Trandaloprilat = Cilazaprilat = Ramiprilat = Perindoprilat> Lisinopril> Enalaprilat> Fosinoprilat> Captopril.
لا تحدد قوة الارتباط بـ ACE قوة عمل مثبطات الإنزيم المحول للأنجيوتنسين فحسب ، بل تحدد أيضًا مدة عملها.
تكون التأثيرات الديناميكية الدوائية لمثبطات الإنزيم المحول للأنجيوتنسين خاصة بالفئة وترتبط بمنع الإنزيم المحول للأنجيوتنسين وتقليل تكوين ATP في الدم والأنسجة مع التخلص من الضغط والتأثيرات العصبية العصبية الأخرى ، فضلاً عن منع تدمير البراديكينين ، مما يساهم في تكوينه. من عوامل توسع الأوعية (PG ، NO) ، يكمل تأثير موسع الأوعية.
الديناميكيات الصيدلانية لمثبطات الإنزيم المحول للأنجيوتنسين
التأثير الدوائي الرئيسي لمثبطات الإنزيم المحول للأنجيوتنسين هو ديناميكا الدم ، ويرتبط بتوسع الأوعية الشرياني المحيطي والوريدية ويتطور نتيجة للتغيرات المعقدة في التنظيم العصبي الرئوي لنظام القلب والأوعية الدموية (قمع نشاط RAAS و SAS). وفقًا لآلية العمل ، فإنها تختلف اختلافًا جوهريًا عن كل من موسعات الأوعية المباشرة ومناهضات الكالسيوم التي تعمل مباشرة على جدار الأوعية الدموية ، وعن موسعات الأوعية الدموية التي تعمل بالمستقبلات (حاصرات ألفا وبيتا). إنها تقلل من مقاومة الأوعية الدموية الطرفية ، وتزيد من النتاج القلبي ولا تؤثر على معدل ضربات القلب بسبب القضاء على التأثير المحفز لـ ATP على SAS. لوحظ التأثير الديناميكي الدموي لمثبطات الإنزيم المحول للأنجيوتنسين بغض النظر عن نشاط الرينين في الدم. يتجلى تأثير توسع الأوعية لمثبطات الإنزيم المحول للأنجيوتنسين من خلال تحسين تدفق الدم الإقليمي في أعضاء وأنسجة المخ والقلب والكلى. في أنسجة الكلى ، مثبطات الإنزيم المحول للأنجيوتنسين لها تأثير تمدد على الشرايين الصادرة (الصادرة) للكبيبات وتقلل من ارتفاع ضغط الدم داخل الكبيبة. كما أنها تسبب التبول اللاإرادي واحتباس البوتاسيوم نتيجة لانخفاض إفراز الألدوستيرون.
الآثار الديناميكية لمثبطات الإنزيم المحول للأنجيوتنسين هي أساس عملها المفرط
التأثير الخافض لضغط الدم لا يرجع فقط إلى انخفاض تكوين ATP ، ولكن أيضًا إلى الوقاية من تدهور البراديكينين ، الذي يحفز الاسترخاء المعتمد على البطانة للعضلات الملساء الوعائية ، من خلال تكوين البروستاجلاندين الموسع للأوعية وعامل الاسترخاء البطاني (NO ).
بالنسبة لمعظم مثبطات الإنزيم المحول للأنجيوتنسين ، يبدأ التأثير الخافض للضغط بعد 1-2 ساعة ، ويتطور التأثير الأقصى في المتوسط بعد 2-6 ساعات ، وتصل مدة التأثير إلى 24 ساعة (باستثناء أقصر مفعول كابتوبريل وإنالابريل ، حيث يستمر تأثيرهما 6-12 ساعة) (الجدول 6.4). يؤثر معدل ظهور التأثير الديناميكي الدموي للمثبطات بشكل مباشر على تحمل وشدة انخفاض ضغط الدم "الجرعة الأولى".
الجدول 6.4
مدة التأثير الخافض لضغط الدم لمثبطات الإنزيم المحول للأنجيوتنسين
لا يعتمد توزيع التأثير الخافض للضغط لمثبطات الإنزيم المحول للأنجيوتنسين بمرور الوقت دائمًا تمامًا على الحرائك الدوائية ، ولا تتميز جميع الأدوية ، حتى طويلة المفعول ، بمؤشر T / p مرتفع (الجدول 6.5).
الجدول 6.5
نسبة T / p لمثبطات الإنزيم المحول للأنجيوتنسين
تعمل مثبطات الإنزيم المحول للأنجيوتنسين على تقليل إفراز النوربينفرين وتفاعل جدار الأوعية الدموية مع التنشيط الودي المضيق للأوعية ، والذي يستخدم في المرضى الذين يعانون من أمراض القلب التاجية في احتشاء عضلة القلب الحاد وخطر عدم انتظام ضربات القلب. في المرضى الذين يعانون من قصور القلب الاحتقاني ، انخفاض في المقاومة الجهازية المحيطية (الحمل اللاحق) والرئوي المقاومة الوعائيةوالضغط الشعري (التحميل المسبق) يؤدي إلى انخفاض في توسع تجاويف القلب ، وتحسين الحشو الانبساطي ، وزيادة النتاج القلبي وزيادة تحمل النشاط البدني. بالإضافة إلى ذلك ، فإن التأثيرات العصبية العصبية لمثبطات الإنزيم المحول للأنجيوتنسين تبطئ إعادة تشكيل القلب والأوعية الدموية.
من خلال منع التأثيرات العصبية الرئوية لـ ATII ، يكون لمثبطات الإنزيم المحول للأنجيوتنسين تأثير واقي عضويًا واضحًا: حماية القلب ، وقائي للأوعية ، وواقي للكلى ؛ تسبب عددًا من التأثيرات الأيضية المفيدة ، وتحسن التمثيل الغذائي للكربوهيدرات والدهون. الآثار المحتملة لمثبطات الإنزيم المحول للأنجيوتنسين معروضة في الجدول. 6.6.
تُظهر مثبطات الإنزيم المحول للأنجيوتنسين تأثيرًا وقائيًا للقلب ، مما يتسبب في تراجع LVH ، ومنع إعادة البناء ، وإصابة عضلة القلب بنقص تروية وإعادة ضخه. التأثير الواقي للقلب خاص بالفئة بالنسبة لجميع مثبطات الإنزيم المحول للأنجيوتنسين ، ويرجع ذلك ، من ناحية ، إلى القضاء على التأثير الغذائي لـ AT11 على عضلة القلب ، ومن ناحية أخرى ، إلى تعديل النشاط الودي ، نظرًا لأن AT11 هو منظم مهم للافراج عن
الجدول 6.6
التأثيرات الدوائية لمثبطات الإنزيم المحول للأنجيوتنسين
 الكاتيكولامينات ، وتثبيط ATP يؤدي إلى انخفاض في التأثير الودي على القلب والأوعية الدموية. عند تنفيذ التأثيرات القلبية لمثبطات الإنزيم المحول للأنجيوتنسين ، ينتمي مكان معين إلى الأقارب. البراديكينين والبروستاجلاندين بسبب التأثير المضاد لنقص تروية الدم وتوسع الشعيرات الدموية وزيادة
الكاتيكولامينات ، وتثبيط ATP يؤدي إلى انخفاض في التأثير الودي على القلب والأوعية الدموية. عند تنفيذ التأثيرات القلبية لمثبطات الإنزيم المحول للأنجيوتنسين ، ينتمي مكان معين إلى الأقارب. البراديكينين والبروستاجلاندين بسبب التأثير المضاد لنقص تروية الدم وتوسع الشعيرات الدموية وزيادة
يساهم توصيل الأكسجين إلى عضلة القلب في زيادة دوران الأوعية الدقيقة واستعادة التمثيل الغذائي ووظيفة ضخ عضلة القلب على خلفية تراجع تضخم البطين الأيسر وفي فترة ما بعد الاحتشاء.
تم إثبات الدور الغالب لمثبطات الإنزيم المحول للأنجيوتنسين في تقليل تضخم البطين الأيسر على الأصناف الأخرى من الأدوية الخافضة للضغط ، ولا توجد علاقة بين شدة التأثير الخافض للضغط وانحدار LVH (يمكن أن تمنع تطور تضخم البطين الأيسر وتليف عضلة القلب حتى في غيابه. من انخفاض في ضغط الدم).
تُظهر مثبطات الإنزيم المحول للأنجيوتنسين تأثيرًا وقائيًا للأوعية ، حيث تلغي تأثيرات ATII على مستقبلات AT 1 للأوعية الدموية ، من ناحية ، ومن ناحية أخرى ، تعمل على تنشيط نظام البراديكينين ، وتحسين وظيفة البطانة وممارسة تأثير مضاد للتكاثر على العضلات الملساء الوعائية.
مثبطات الإنزيم المحول للأنجيوتنسين لها تأثير مضاد لتصلب الشرايين ، وآليتها هي تأثيرات مضادة للتكاثر ومضادة للهجرة على خلايا العضلات الملساء الوعائية والخلايا الأحادية ، وانخفاض في تكوين مصفوفة الكولاجين ، وتأثير مضاد للأكسدة ومضاد للالتهابات. يتم استكمال التأثير المضاد لتصلب الشرايين من خلال تقوية تحلل الفبرين الداخلي عن طريق مثبطات الإنزيم المحول للأنجيوتنسين وعمل مضاد للصفيحات (تثبيط تراكم الصفائح الدموية) ؛ انخفاض في تصلب الشرايين في البلازما (انخفاض في LDL والدهون الثلاثية و زيادة HDL) ؛ أنها تمنع تمزق اللويحة وتصلب الشرايين. تظهر الخصائص المضادة لتصلب الشرايين في الدراسات السريرية لراميبريل ، كينابريل.
مثبطات الإنزيم المحول للأنجيوتنسين لها تأثير هام على الكلى ، حيث تمنع تطور الفشل الكلوي وتقلل من بروتينية. التأثير الوقائي للكلية خاص بالفئة ويمتاز بجميع الأدوية. توسع الشرايين السائدة في الكبيبات الكلوية يترافق مع انخفاض في ضغط الترشيح داخل الكبيبة ، وجزء الترشيح والتصفية المفرطة ، مما يؤدي إلى انخفاض في البيلة البروتينية (بروتينات ذات وزن جزيئي منخفض بشكل رئيسي) في المرضى الذين يعانون من اعتلال الكلية السكري وارتفاع ضغط الدم. تظهر التأثيرات الكلوية ، بسبب الحساسية العالية للأوعية الكلوية لتأثير توسع الأوعية لمثبطات الإنزيم المحول للأنجيوتنسين ، في وقت أبكر من انخفاض مقاومة الأوعية الدموية الطرفية ويتم التوسط فيها جزئيًا فقط من خلال التأثير الخافض للضغط. تعتمد آلية التأثير المضاد للبروتين لمثبطات الإنزيم المحول للأنجيوتنسين على التأثير المضاد للالتهابات على الغشاء القاعدي الكبيبي والتأثير المضاد للتكاثر.
على خلايا مسراق الكبيبة ، مما يقلل من نفاذية البروتينات ذات الوزن الجزيئي المتوسط والعالي. بالإضافة إلى ذلك ، فإن مثبطات الإنزيم المحول للأنجيوتنسين تقضي على التأثيرات الغذائية لـ ATII ، والتي من خلال تحفيز نمو خلايا ميسانجيل ، وإنتاج الكولاجين وعامل نمو البشرة للأنابيب الكلوية ، يسرع من تطور تصلب الكلى.
لقد ثبت أن محبة الدهون لمثبطات الإنزيم المحول للأنجيوتنسين تحدد التأثير على الأنسجة RAS ، وربما التأثيرات الواقية للأعضاء (الجدول 6.8).
يتم عرض الحرائك الدوائية المقارنة لمثبطات الإنزيم المحول للأنجيوتنسين في الجدول. 6.9
السمة الدوائية المميزة لمعظم مثبطات الإنزيم المحول للأنجيوتنسين (باستثناء كابتوبريل وليزينوبريل) هي
الجدول 6.8
مؤشر محبة للدهون أشكال نشطةمثبطات الإنزيم المحول للأنجيوتنسين
 ملحوظة.تشير القيمة السالبة إلى قابلية الماء.
ملحوظة.تشير القيمة السالبة إلى قابلية الماء.
التمثيل الغذائي الواضح في الكبد ، بما في ذلك الجهاز التحضيري ، مما يؤدي إلى تكوين مستقلبات نشطة ويصاحبها تقلب فردي كبير. هذه الحرائك الدوائية تجعل مثبطات الإنزيم المحول للأنجيوتنسين تبدو مثل "العقاقير الأولية" التأثير الدوائيوالذي ، بعد تناوله عن طريق الفم ، يرجع إلى تكوين مستقلبات نشطة في الكبد. في روسيا ، يتم تسجيل شكل حقني من إنالابريل - نظير اصطناعي من إنالابريلات ، والذي يستخدم للتخفيف من أزمات ارتفاع ضغط الدم.
يتم الوصول إلى أقصى تركيز لمثبطات الإنزيم المحول للأنجيوتنسين في بلازما الدم بعد 1-2 ساعة ويؤثر على معدل تطور انخفاض ضغط الدم. ترتبط مثبطات الإنزيم المحول للأنجيوتنسين بشدة ببروتينات البلازما (70-90٪). عمر النصف متغير: من 3 ساعات إلى 24 ساعة أو أكثر ، على الرغم من أن الحرائك الدوائية لها تأثير أقل على مدة تأثير الدورة الدموية. هناك ثلاث مراحل في وقت مبكر
تراجعها السريع ، مما يعكس مرحلة التوزيع (T 1/2 a) ؛ المرحلة الأولية للتخلص ، مما يعكس القضاء على الجزء غير المرتبط بنسيج ACE (T 1/2 b) ؛ مرحلة التخلص النهائي الطويلة ، والتي تعكس التخلص من الجزء المنفصل من المستقلبات النشطة من المركب باستخدام ACE ، والتي يمكن أن تصل إلى 50 ساعة (لراميبريل) وتحدد فترة الجرعات.
يتم استقلاب الأدوية بشكل إضافي لتكوين جلوكورونيدات (باستثناء ليسينوبريل وسيلازابريل). أعظم الأهمية السريريةلديهم مسارات للتخلص من مثبطات الإنزيم المحول للأنجيوتنسين:
في الغالب كلوي (أكثر من 60 ٪) - ليسينوبريل ، سيلازابريل ، إنالابريل ، كينابريل ، بيريندوبريل ؛ القنوات الصفراوية (spirapril ، trandolapril) أو مختلطة. يعتبر إفراز القنوات الصفراوية بديلاً هامًا للتخلص الكلوي ، خاصة في وجود مرض الكلى المزمن.
دواعي الإستعمال
ارتفاع ضغط الدم الشرياني(الجدول 6.9). مثبطات الإنزيم المحول للأنجيوتنسين لها تأثير خافض للضغط في جميع أشكال ارتفاع ضغط الدم تقريبًا ، بغض النظر عن نشاط الرينين في البلازما. لا يتغير Baroreflex وردود الفعل القلبية الوعائية الأخرى ، ولا يوجد انخفاض ضغط الدم الانتصابي. تصنف هذه الفئة من الأدوية على أنها أدوية الخط الأول في علاج ارتفاع ضغط الدم. العلاج الأحادي فعال في 50٪ من مرضى ارتفاع ضغط الدم. بالإضافة إلى تأثيرها الخافض للضغط ، فإن مثبطات الإنزيم المحول للأنجيوتنسين في مرضى ارتفاع ضغط الدم تقلل من خطر الإصابة بأمراض القلب والأوعية الدموية (ربما أكثر من الأدوية الأخرى الخافضة للضغط). مثبطات الإنزيم المحول للأنجيوتنسين هي الأدوية المختارة في مزيج من ارتفاع ضغط الدم و السكريبسبب انخفاض كبير في مخاطر القلب والأوعية الدموية.
ضعف البطين الأيسر الانقباضي وفشل القلب المزمن.يجب وصف مثبطات الإنزيم المحول للأنجيوتنسين لجميع المرضى الذين يعانون من ضعف في البطين الأيسر ، بغض النظر عن وجود أعراض قصور القلب. تعمل مثبطات الإنزيم المحول للأنجيوتنسين على منع وإبطاء تطور قصور القلب الاحتقاني ، وتقلل من خطر الإصابة بالـ AMI والموت المفاجئ ، وتقلل من الحاجة إلى الاستشفاء. تقلل مثبطات الإنزيم المحول للأنجيوتنسين من توسع البطين الأيسر وتمنع إعادة تشكيل عضلة القلب وتقليل تصلب القلب. تزداد فعالية مثبطات الإنزيم المحول للأنجيوتنسين مع شدة ضعف البطين الأيسر.
فشل قلبي حاد.استخدام مثبطات الإنزيم المحول للأنجيوتنسين في التواريخ المبكرةفي احتشاء عضلة القلب الحاد يقلل من وفيات المرضى. مثبطات الإنزيم المحول للأنجيوتنسين فعالة بشكل خاص على خلفية ارتفاع ضغط الدم والسكري والمرضى المعرضين لمخاطر عالية.
داء السكري واعتلال الكلية السكري.تعمل جميع مثبطات الإنزيم المحول للأنجيوتنسين على إبطاء تطور تلف الكلى في النوع الأول والنوع الثاني من داء السكري ، بغض النظر عن مستويات ضغط الدم. تعمل مثبطات الإنزيم المحول للأنجيوتنسين على إبطاء تطور الفشل الكلوي المزمن في أمراض الكلى الأخرى. يصاحب الاستخدام طويل الأمد لمثبطات الإنزيم المحول للأنجيوتنسين انخفاض في حدوث مضاعفات داء السكري والقلب والأوعية الدموية
الجدول 6.9
مؤشرات لمثبطات الإنزيم المحول للأنجيوتنسين
مضاعفات. يترافق استخدام مثبطات الإنزيم المحول للأنجيوتنسين مع انخفاض حدوث حالات جديدة من داء السكري مقارنة بالأدوية الأخرى الخافضة للضغط (مدرات البول ، حاصرات بيتا ، مضادات الكالسيوم).
موانع
يُمنع استخدام مثبطات الإنزيم المحول للأنجيوتنسين في المرضى الذين يعانون من تضيق ثنائي الشرايين الكلويةأو تضيق في كلية واحدة ، وكذلك بعد زرع الكلى (خطر الإصابة بالفشل الكلوي) ؛ في المرضى الذين يعانون من الفشل الكلوي الحاد. فرط بوتاسيوم الدم. مع تضيق الأبهر الشديد (مع ضعف ديناميكا الدم) ؛ مع وذمة وعائية ، بما في ذلك بعد استخدام أي من مثبطات الإنزيم المحول للأنجيوتنسين.
مثبطات الإنزيم المحول للأنجيوتنسين هي بطلان في الحمل. يؤدي استخدام مثبطات الإنزيم المحول للأنجيوتنسين أثناء الحمل إلى تأثيرات سامة على الجنين: في الأشهر الثلاثة الأولى من الحمل ، يتم وصف تشوهات القلب والأوعية الدموية والكلى والدماغ ؛ في الثلث الثاني والثالث من الحمل - يؤدي إلى انخفاض ضغط الدم لدى الجنين ونقص تنسج الجمجمة والفشل الكلوي وانقطاع البول وحتى موت الجنين ، لذلك يجب إلغاء مثبطات الإنزيم المحول للأنجيوتنسين فور تحديد الحمل.
الحذر مطلوب عندما أمراض المناعة الذاتية، الكولاجين ، وخاصة الذئبة الحمامية الجهازية أو تصلب الجلد
(يزيد خطر الإصابة بقلة العدلات أو ندرة المحببات) ؛ تثبيط نخاع العظام.
مبادئ الجرعات. جرعات مثبطات الإنزيم المحول للأنجيوتنسين لها خصائصها الخاصة المرتبطة بخطر حدوث تأثير ديناميكي (خافض للضغط) واضح وتتضمن استخدام طريقة معايرة الجرعة - استخدام جرعة أولية منخفضة من الدواء ، متبوعة بزيادتها على فترات أسبوعين حتى يتم الوصول إلى متوسط الجرعة العلاجية (المستهدفة). من المهم تحقيق الجرعة المستهدفة لكل من علاج ارتفاع ضغط الدم ، وعلاج قصور القلب الاحتقاني ، واعتلال الكلية ، حيث أنه عند هذه الجرعات يتم ملاحظة الحد الأقصى من التأثير العضوي لمثبطات الإنزيم المحول للأنجيوتنسين.
الجدول 6.10
جرعات مثبطات الإنزيم المحول للأنجيوتنسين
الآثار الجانبية لمثبطات الإنزيم المحول للأنجيوتنسين
مثبطات الإنزيم المحول للأنجيوتنسين ، بسبب آلية مشتركةالإجراءات المرتبطة بالحجب غير الانتقائي لإنزيم ACE لها نفس الآثار الجانبية الخاصة بالفئة (PE). خاص بفئة K.
تشمل مثبطات Kim PE ACE: 1) الأكثر شيوعًا - انخفاض ضغط الدم والسعال والطفح الجلدي وفرط بوتاسيوم الدم. 2) أقل تواترا - وذمة وعائية ، واضطرابات تكوين الدم ، والتذوق واختلال وظائف الكلى (على وجه الخصوص ، في المرضى الذين يعانون من تضيق ثنائي في الشرايين الكلوية وفشل القلب الاحتقاني الذين يتلقون مدرات البول).
إن انخفاض ضغط الدم "الجرعة الأولى" والدوخة المصاحبة له هي أمور شائعة في جميع مثبطات الإنزيم المحول للأنجيوتنسين. هم مظهر من مظاهر تأثير الدورة الدموية (تردد يصل إلى 2 ٪ ، مع فشل القلب - حتى 10 ٪). متكرر بشكل خاص بعد تناول الجرعة الأولى ، في المرضى المسنين ، في المرضى الذين يعانون من ارتفاع نشاط الرينين في البلازما ، مع قصور القلب المزمن ، ونقص صوديوم الدم وما يصاحب ذلك من استخدام مدرات البول. لتقليل شدة انخفاض ضغط الدم "الجرعة الأولى" ، يوصى بالمعايرة البطيئة لجرعات الدواء.
السعال هو فئة معينة من PE من مثبطات الإنزيم المحول للأنجيوتنسين. يختلف تواتر حدوثه بشكل كبير من 5 إلى 20 ٪ ، وفي كثير من الأحيان لا يعتمد على جرعة الأدوية ، ويحدث بشكل رئيسي عند النساء. ترتبط آلية تطور السعال بتنشيط نظام kinin-kallikrein بسبب منع الإنزيم المحول للأنجيوتنسين. في الوقت نفسه ، يمكن أن يتراكم البراديكينين محليًا في جدار الشعب الهوائية وينشط الببتيدات الأخرى المؤيدة للالتهابات (على سبيل المثال ، المادة P ، الببتيد العصبي Y) ، وكذلك الهيستامين ، الذي يؤثر على وظيفة القصبات الحركية ويسبب السعال. إلغاء مثبطات الإنزيم المحول للأنجيوتنسين يوقف السعال تمامًا.
فرط بوتاسيوم الدم (أعلى من 5.5 مليمول / لتر) هو نتيجة لانخفاض في إفراز الألدوستيرون الذي يحدث عند منع تكوين ATP ، ويمكن ملاحظته في المرضى الذين يعانون من الفشل الكلوي المزمن ، أثناء تناول مدرات البول التي تقتصد البوتاسيوم ، ومستحضرات البوتاسيوم.
يرتبط الطفح الجلدي والوذمة الوعائية (وذمة كوينك) بزيادة مستويات البراديكينين.
يمكن ملاحظة اختلال وظائف الكلى (زيادة الكرياتينين والنيتروجين المتبقي في بلازما الدم) في بداية العلاج بمثبطات الإنزيم المحول للأنجيوتنسين ، وهو أمر عابر. يمكن ملاحظة زيادة كبيرة في الكرياتينين في البلازما في المرضى الذين يعانون من قصور القلب الاحتقاني وتضيق الشريان الكلوي ، مصحوبًا بارتفاع نشاط الرينين في البلازما وتشنج الشرايين الصادرة ؛ في هذه الحالات ، يكون سحب الدواء ضروريًا.
قلة الكريات البيض ، قلة الصفيحات وندرة المحببات نادرة للغاية (أقل من 0.5٪).
الجدول 6.11
التفاعلات الدوائية مثبطات الإنزيم المحول للأنجيوتنسين
الأدوية المتداخلة | آلية التفاعل | نتيجة التفاعل |
مدرات البول الثيازيد ، حلقة | نقص الصوديوم والسوائل | انخفاض ضغط الدم الشديد ، خطر الإصابة بالفشل الكلوي |
توفير البوتاسيوم | قلة تكوين الألدوستيرون | فرط بوتاسيوم الدم |
العوامل الخافضة للضغط | زيادة نشاط الرينين أو الودي | تقوية التأثير الخافض للضغط |
مضادات الالتهاب غير الستيروئيدية (خاصة الإندوميتاسين) | قمع تخليق PG في الكلى واحتباس السوائل | |
مكملات البوتاسيوم ، المكملات الغذائيةتحتوي على البوتاسيوم | الديناميكية الدوائية | فرط بوتاسيوم الدم |
الأدوية التي تمنع تكون الدم | الديناميكية الدوائية | خطر قلة العدلات وندرة المحببات |
الإستروجين | احتباس السوائل | انخفاض تأثير خافض للضغط |
تفاعل الأدوية
لا تحتوي مثبطات الإنزيم المحول للأنجيوتنسين على تفاعلات حركية دوائية ؛ جميع التفاعلات الدوائية معهم ديناميكية دوائية.
تتفاعل مثبطات الإنزيم المحول للأنجيوتنسين مع الأدوية المضادة للالتهابات غير الستيرويدية ومدرات البول ومستحضرات البوتاسيوم والأدوية الخافضة للضغط (الجدول 6.11). يمكن أن يؤدي الجمع بين مثبطات الإنزيم المحول للأنجيوتنسين مع مدرات البول والأدوية الأخرى الخافضة للضغط إلى زيادة التأثير الخافض للضغط ، بينما تستخدم مدرات البول لتقوية التأثير الخافض لضغط الدم لمثبطات الإنزيم المحول للأنجيوتنسين. عند الدمج مع الأدوية المضادة للالتهابات غير الستيرويدية (باستثناء الأسبرين بجرعات أقل من 150 ملغ / يوم) ، يمكن أن يؤدي ذلك إلى إضعاف التأثير الخافض لضغط الدم لمثبطات الإنزيم المحول للأنجيوتنسين بسبب احتباس السوائل وإعاقة تخليق PG في الأوعية الدموية حائط. قد تزيد مدرات البول الموفرة للبوتاسيوم والعوامل الأخرى المحتوية على K + (مثل KCl ومكملات البوتاسيوم) من خطر فرط بوتاسيوم الدم. يمكن للأدوية المحتوية على الإستروجين أن تقلل من التأثير الخافض لضغط الدم لمثبطات الإنزيم المحول للأنجيوتنسين. يجب توخي الحذر عند المشاركة في إدارة الأدوية مع تأثيرات اكتئاب النخاع.
الجدول 6.12
حركية الدواء لمثبطات الإنزيم المحول للأنجيوتنسين
للاقتباس:ليونوفا م. الأدوية الجديدة والواعدة التي تثبط نظام الرينين-أنجيوتنسين-الألدوستيرون // RMJ. المراجعة الطبية. 2013. رقم 17. ص 886
يعتبر دور نظام الرينين-أنجيوتنسين-الألدوستيرون (RAAS) في تطور ارتفاع ضغط الدم الشرياني (AH) وأمراض القلب والأوعية الدموية الأخرى هو المسيطر حاليًا. في استمرارية القلب والأوعية الدموية ، يعتبر ارتفاع ضغط الدم من بين عوامل الخطر ، والآلية المرضية الفيزيولوجية المرضية الرئيسية لتلف نظام القلب والأوعية الدموية هي أنجيوتنسين 2 (ATII). ATII هو أحد المكونات الرئيسية لـ RAAS - المستجيب الذي ينفذ تضيق الأوعية ، واحتباس الصوديوم ، وتنشيط الجهاز العصبي الودي ، وتكاثر الخلايا وتضخمها ، وتطوير الإجهاد التأكسدي والتهاب جدار الأوعية الدموية.
في الوقت الحاضر ، لقد تطورت بالفعل على نطاق واسع التطبيق السريريفئتان من الأدوية التي تمنع RAAS هما مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبلات ATII. تختلف التأثيرات الدوائية والسريرية لهذه الفئات. إن الإنزيم المحول للأنجيوتنسين عبارة عن ببتيداز بروتين معدني الزنك الذي يستقلب ATI و AT1-7 والبراديكينين والمادة P والعديد من الببتيدات الأخرى. ترتبط آلية عمل مثبطات الإنزيم المحول للأنجيوتنسين بشكل أساسي بمنع تكوين ATII ، الذي يعزز توسع الأوعية ، والتهاب الغدد الليمفاوية ، ويزيل التأثيرات المسببة للالتهابات والتكاثرية والآثار الأخرى لـ ATII. بالإضافة إلى ذلك ، تمنع مثبطات الإنزيم المحول للأنجيوتنسين تحلل البراديكينين وتزيد من مستواه. يعتبر براديكينين موسعًا قويًا للأوعية الدموية ، فهو يقوي التبول اللاإرادي ، والأهم من ذلك أن له تأثير وقائي للقلب (يمنع تضخم ، ويقلل إصابة نقص ترويةعضلة القلب ، يحسن إمداد الدم في الشريان التاجي) والعمل الوقائي للأوعية ، ويحسن وظيفة البطانة. لكن، مستوى عالالبراديكينين هو سبب تطور الوذمة الوعائية ، وهو أحد العيوب الخطيرة لمثبطات الإنزيم المحول للأنجيوتنسين ، والتي تزيد بشكل كبير من مستوى الأقارب.
لا تستطيع مثبطات الإنزيم المحول للأنجيوتنسين دائمًا منع تكوين ATII في الأنسجة تمامًا. لقد ثبت الآن أن الإنزيمات الأخرى غير المرتبطة بالأنزيم المحول للأنجيوتنسين ، وبشكل أساسي endopeptidases ، والتي لا تتأثر بمثبطات الإنزيم المحول للأنجيوتنسين ، يمكن أن تشارك أيضًا في تحولها في الأنسجة. نتيجة لذلك ، لا تستطيع مثبطات الإنزيم المحول للأنجيوتنسين القضاء تمامًا على تأثيرات ATII ، والتي قد تكون سبب عدم فعاليتها.
تم تسهيل حل هذه المشكلة من خلال اكتشاف مستقبلات ATII والفئة الأولى من الأدوية التي تمنع بشكل انتقائي مستقبلات AT1. من خلال مستقبلات AT1 ، تتحقق التأثيرات غير المواتية لـ ATII: تضيق الأوعية ، وإفراز الألدوستيرون ، والفازوبريسين ، والنورادرينالين ، واحتباس السوائل ، وتكاثر خلايا العضلات الملساء وخلايا عضلة القلب ، وتنشيط SAS ، وكذلك آلية التغذية الراجعة السلبية - تكوين الرينين . تؤدي مستقبلات AT2 وظائف "مفيدة" ، مثل توسع الأوعية ، وعمليات الإصلاح والتجديد ، والعمل المضاد للتكاثر ، وتمايز وتطور الأنسجة الجنينية. يتم التوسط في التأثيرات السريرية لحاصرات مستقبلات ATII من خلال القضاء على التأثيرات "الضارة" لـ ATII على مستوى مستقبلات AT1 ، مما يوفر منعًا أكثر اكتمالا للتأثيرات الضارة لـ ATII وزيادة تأثير ATII على مستقبلات AT2 ، الذي يكمل تأثيرات توسع الأوعية ومضاد التكاثر. حاصرات مستقبلات ATII لها تأثير محدد على RAAS دون التدخل في نظام kinin. قلة التأثير على نشاط نظام الكينين ، من ناحية ، يقلل من شدة الآثار غير المرغوب فيها (السعال ، الوذمة الوعائية) ، ولكن من ناحية أخرى ، يحرم حاصرات مستقبلات ATII من تأثير مهم مضاد للإقفار ووقائي للأوعية ، مما يميزها عن مثبطات الإنزيم المحول للأنجيوتنسين. لهذا السبب ، فإن مؤشرات استخدام حاصرات مستقبلات ATII في الأغلبية تكرر مؤشرات تعيين مثبطات الإنزيم المحول للأنجيوتنسين ، مما يجعلها أدوية بديلة.
على الرغم من إدخال حاصرات RAAS في الممارسة الواسعة الانتشار لعلاج ارتفاع ضغط الدم ، لا تزال مشاكل تحسين النتائج والتشخيص قائمة. وتشمل هذه: إمكانية تحسين التحكم في ضغط الدم لدى السكان ، وفعالية علاج ارتفاع ضغط الدم المقاوم ، وإمكانية الحد من مخاطر الإصابة بأمراض القلب والأوعية الدموية.
البحث عن طرق جديدة للتأثير على RAAS مستمر بشكل نشط ؛ يتم دراسة أنظمة أخرى متفاعلة بشكل وثيق ويتم تطوير الأدوية ذات آليات العمل المتعددة ، مثل مثبطات الإنزيم المحول للأنجيوتنسين ومثبطات الإندوببتيداز المحايدة (NEP) ، ومثبطات الإنزيم المحول للبطين (EPF) ومثبطات NEP ، ومثبطات ACE / NEP / EPF.
مثبطات Vasopeptidase
بالإضافة إلى الإنزيم المحول للأنجيوتنسين المعروف ، فإن vasopeptidases تشمل 2 من البروتينات المعدنية الأخرى للزنك - neprilysin (endopeptidase المحايد ، NEP) والإنزيم المحول للبطانة ، والتي يمكن أن تكون أيضًا أهدافًا للتأثيرات الدوائية.
نيبريليسين هو إنزيم تنتجه البطانة الوعائية ويشارك في تحلل الببتيد الناتريوتريك وكذلك البراديكينين.
يتم تمثيل نظام الببتيد الناتريوتريك بثلاثة أشكال مختلفة: الببتيد الأذيني المدر للصوديوم (النوع A) ، الببتيد المدر للصوديوم في المخ (النوع B) ، والتي يتم تصنيعها في الأذين وعضلة القلب ، والببتيد C البطاني ، وهي مثبطات RAAS داخلية المنشأ في وظائفهم البيولوجية. و endothelin-1 (الجدول 1). إن التأثيرات القلبية الوعائية والكلوية للببتيد الناتريوتريك هي تقليل ضغط الدم من خلال التأثير على قوة الأوعية الدموية وتوازن الماء والكهارل ، وكذلك في التأثيرات المضادة للتكاثر ومضاد التليف على الأعضاء المستهدفة. في الآونة الأخيرة ، يشارك نظام الببتيد الناتريوتريك في تنظيم التمثيل الغذائي لأكسدة الدهون ، وتكوين الخلايا الشحمية والتمايز ، وتنشيط الأديبونكتين ، وإفراز الأنسولين ، وتحمل الكربوهيدرات ، مما قد يمنح الحماية ضد تطور متلازمة التمثيل الغذائي.
حتى الآن ، أصبح من المعروف أن تطور أمراض القلب والأوعية الدموية يرتبط بخلل في نظام الببتيد الناتريوتريك. لذلك ، في ارتفاع ضغط الدم ، هناك نقص في الببتيد الناتريوتريك ، مما يؤدي إلى حساسية الملح وإعاقة البول. في قصور القلب المزمن (CHF) ، على خلفية النقص ، لوحظ عمل غير طبيعي لهرمونات نظام الببتيد الناتريوتريك.
لذلك ، يمكن استخدام مثبطات NEP لتقوية نظام الببتيد الناتريوتريك من أجل تحقيق تأثيرات قلبية كلوية خافضة للضغط ووقائية إضافية. يؤدي تثبيط النبريليزين إلى تقوية التأثيرات المدرة للبول والمدر للبول والتوسع الوعائي للببتيد الناتريوتريك الداخلي ، ونتيجة لذلك ، يؤدي إلى انخفاض ضغط الدم. ومع ذلك ، تشارك NEP أيضًا في تدهور الببتيدات الأخرى النشطة في الأوعية ، ولا سيما ATI و ATII و endothelin-1. لذلك ، فإن توازن التأثيرات على النغمة الوعائية لمثبطات NEP متغير ويعتمد على غلبة تأثيرات التضييق والتوسع. مع الاستخدام المطول ، يتم التعبير عن التأثير الخافض للضغط لمثبطات النبريليزين بشكل ضعيف بسبب التنشيط التعويضي لتشكيل ATII و endothelin-1.
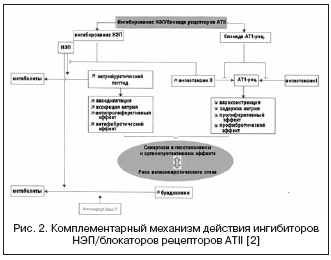
في هذا الصدد ، يمكن أن يؤدي الجمع بين تأثيرات مثبطات الإنزيم المحول للأنجيوتنسين ومثبطات NEP إلى زيادة التأثيرات الديناميكية الدموية ومضادات التكاثر بشكل كبير نتيجة لآلية العمل التكميلية ، مما أدى إلى إنشاء أدوية ذات آلية عمل مزدوجة ، متحدة تحت الاسم - مثبطات فازوبيبتيداز (الجدول 2 ، الشكل 1).
تتميز مثبطات vasopeptidase المعروفة بـ درجات متفاوتهالانتقائية إلى NEP / ACE: omapatrilat - 8.9: 0.5 ؛ فازيدوبريلات - 5.1: 9.8 ؛ سامباتريلات - 8.0: 1.2. نتيجة لذلك ، تلقت مثبطات vasopeptidase فرصًا أكبر بكثير لتحقيق تأثير خافض للضغط ، بغض النظر عن نشاط RAAS ومستوى احتباس الصوديوم ، وفي حماية الأعضاء (تراجع التضخم ، الزلال ، تصلب الأوعية الدموية). أكثر الدراسات التي تمت دراستها في الدراسات السريرية كانت omapatrilat ، والتي أظهرت فعالية أعلى لضغط الدم مقارنة بمثبطات الإنزيم المحول للأنجيوتنسين ، وفي المرضى الذين يعانون من قصور القلب الاحتقاني أدى إلى زيادة في جزء الإخراج وتحسين النتائج السريرية (دراسات IMPRESS و OVERTURE) ، ولكن دون مزايا مقارنة بمثبطات الإنزيم المحول للأنجيوتنسين.
ومع ذلك ، في التجارب السريرية الكبيرة باستخدام omapatrilat ، تم العثور على نسبة أعلى من الوذمة الوعائية مقارنة بمثبطات الإنزيم المحول للأنجيوتنسين. من المعروف أن نسبة حدوث الوذمة الوعائية عند استخدام مثبطات الإنزيم المحول للأنجيوتنسين تتراوح من 0.1 إلى 0.5٪ في السكان ، منها 20٪ حالات مهددة للحياة ، وهو ما يرتبط بزيادة متعددة في تراكيز البراديكينين ومستقلباته. أظهرت نتائج دراسة كبيرة متعددة المراكز OCTAVE (العدد = 25 302) ، والتي صممت خصيصًا لدراسة حدوث الوذمة الوعائية ، أن حدوث هذا أثر جانبيعلى خلفية العلاج باستخدام omapatrilat يتجاوز ذلك في مجموعة enalapril - 2.17٪ مقابل 0.68٪ (الخطر النسبي 3.4). تم تفسير ذلك من خلال زيادة التأثير على مستوى الأقارب أثناء التثبيط التآزري لـ ACE و NEP ، المرتبط بتثبيط aminopeptidase P ، والذي يشارك في تحلل البراديكينين.
إن مثبط إنزيم ACE / NEP المزدوج الجديد الذي يمنع vasopeptidase ، ilepatril ، لديه تقارب أعلى لـ ACE من NEP. عند دراسة التأثيرات الديناميكية الدوائية لـ ilepatril على التأثير على نشاط RAAS والببتيد الناتريوتريك لدى متطوعين أصحاء ، وجد أن الدواء يعتمد على الجرعة (بجرعات 5 و 25 مجم) وبشكل ملحوظ (أكثر من 88٪) يثبط ACE في البلازما لأكثر من 48 ساعة بغض النظر عن حساسية الملح. في الوقت نفسه ، زاد الدواء بشكل كبير من نشاط الرينين في البلازما لمدة 48 ساعة وخفض مستوى الألدوستيرون. أظهرت هذه النتائج قمعًا واضحًا وأطول لـ RAAS ، على عكس مثبط الإنزيم المحول للأنجيوتنسين راميبريل بجرعة 10 ملغ ، والذي تم تفسيره من خلال تأثير الأنسجة الأكثر أهمية لـ ilepatril على ACE وتقارب أكبر لـ ACE ، ودرجة مماثلة. من الحصار المفروض على RAAS مقارنة بمزيج من irbesartan 150 mg + 10 mg ramipril. على عكس التأثير على RAAS ، فإن تأثير ilepatril على الببتيد الناتريوتريك تجلى من خلال زيادة عابرة في مستوى إفرازه في فترة 4-8 ساعات بعد جرعة 25 مجم ، مما يشير إلى تقارب أقل وأضعف لنيب ويميزها عن أوماباتريلات. علاوة على ذلك ، من حيث مستوى إفراز المنحل بالكهرباء ، فإن الدواء ليس له تأثير ناتريوتريك إضافي مقارنة براميبريل أو إربيسارتان ، وكذلك مثبطات فاسوبيبتيداز الأخرى. يتطور الحد الأقصى من التأثير الخافض للضغط بعد 6-12 ساعة من تناول الدواء ، ويبلغ الانخفاض في متوسط ضغط الدم 5 ± 5 و 10 ± 4 مم زئبق. عند حساسية منخفضة وعالية للملح ، على التوالي. وفقًا لخصائص الحرائك الدوائية ، فإن ilepatril هو دواء أولي مع مستقلب نشط ، والذي يتشكل بسرعة مع تحقيق أقصى تركيزبعد 1-1.5 ساعة ويزول ببطء. المرحلة الثالثة من التجارب السريرية جارية حاليًا.
يتم تمثيل طريق بديل للقمع المزدوج لـ RAAS و NEP من خلال مجموعة من الحصار المفروض على مستقبلات ATII و NEP (الشكل 2). لا تؤثر حاصرات مستقبلات ATII على استقلاب الأقارب ، على عكس مثبطات الإنزيم المحول للأنجيوتنسين ، لذلك يحتمل أن يكون لديهم خطر أقل للإصابة بالوذمة الوعائية. حاليا في المرحلة الثالثة الأبحاث السريريةالدواء الأول هو مانع مستقبلات ATII مع تأثير تثبيط NEP بنسبة 1: 1 - LCZ696. يحتوي جزيء الدواء المركب على فالسارتان ومثبط NEP (AHU377) في شكل دواء أولي. في دراسة كبيرة أجريت على مرضى ارتفاع ضغط الدم (العدد = 1328) ، أظهر LCZ696 بجرعات 200-400 مجم ميزة في التأثير الخافض للضغط على فالسارتان بجرعات 160-320 مجم في شكل انخفاض إضافي في ضغط الدم بمقدار 5 / 3 و 6/3 مم زئبق. . كان التأثير الخافض لضغط الدم لـ LCZ696 مصحوبًا بانخفاض أكثر وضوحًا في ضغط النبض: بمقدار 2.25 و 3.32 ملم زئبق. بجرعات 200 و 400 مجم ، على التوالي ، والتي تعتبر حاليًا عاملاً تنبؤيًا إيجابيًا للتأثير على تصلب جدار الأوعية الدموية ونتائج القلب والأوعية الدموية. في الوقت نفسه ، أظهرت دراسة المؤشرات الحيوية العصبية أثناء العلاج بـ LCZ696 زيادة في مستوى الببتيد الناتريوتريك بدرجة مماثلة من الزيادة في مستوى الرينين والألدوستيرون مقارنة مع فالسارتان. كان التحمل في المرضى المصابين بارتفاع ضغط الدم جيدًا ، ولم يتم ملاحظة أي حالات من الوذمة الوعائية. تم الانتهاء الآن من تجربة PARAMOUMT في 685 مريضًا يعانون من قصور القلب الاحتقاني و EF. أظهرت نتائج الدراسة أن LCZ696 يقلل من مستوى NT-proBNP بشكل أسرع وأكثر وضوحًا (نقطة النهاية الأولية هي علامة على زيادة نشاط الببتيد الناتريوتريك وسوء التشخيص في CHF) مقارنة بفالسارتان ، ويقلل أيضًا من حجم الأذين الأيسر ، مما يشير إلى تراجع في إعادة تشكيلها. تجري دراسة على المرضى الذين يعانون من قصور القلب الاحتقاني وانخفاض EF (دراسة PARADIGM-HF).
مثبطات نظام الإندوثيلين
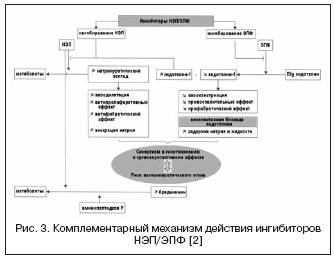
يلعب نظام البطانة الداخلية دورًا مهمًا في تنظيم توتر الأوعية الدموية وتدفق الدم الإقليمي. من بين الأشكال الإسفينية الثلاثة المعروفة ، يعتبر endothelin-1 هو الأكثر نشاطًا. بالإضافة إلى التأثيرات المعروفة لمضيق الأوعية ، فإن الإندوثيلين يحفز تكاثر وتوليف المصفوفة بين الخلايا ، وأيضًا ، بسبب التأثير المباشر على نبرة الأوعية الكلوية ، يشارك في تنظيم توازن الماء والكهارل. تتحقق تأثيرات الإندوثيلين من خلال التفاعل مع مستقبلات محددة من النوع A و B ، ووظائفهما متناقضة: يحدث تضيق الأوعية من خلال مستقبلات من النوع A ، ويحدث توسع الأوعية من خلال النوع B. في السنوات الاخيرةثبت أن المستقبلات من النوع B تلعب دورًا مهمًا في إزالة endothelin-1 ، أي يؤدي الحصار المفروض على هذه المستقبلات إلى تعطيل التصفية المعتمدة على مستقبلات endothelin-1 وزيادة تركيزه. بالإضافة إلى ذلك ، تشارك المستقبلات من النوع B في تنظيم التأثيرات الكلوية للإندوثيلين -1 والحفاظ على توازن الماء والكهارل ، وهو أمر مهم.
حاليًا ، تم إثبات دور الإندوثيلين في تطوير عدد من الأمراض ، بما في ذلك. AH ، CHF ، ارتفاع ضغط الدم الرئوي ، أمراض الكلى المزمنة. يظهر علاقة وثيقة بين مستوى البطانة ومتلازمة التمثيل الغذائي ، والخلل البطاني وتصلب الشرايين. منذ التسعينيات يجري البحث عن مضادات مستقبلات الإندوثيلين المناسبة للاستخدام السريري ؛ 10 عقاقير معروفة بالفعل ("Sentans") بدرجات متفاوتة من الانتقائية للمستقبلات من النوع A / B. أظهر أول مضاد لمستقبلات الإندوثيلين غير الانتقائي - بوسنتان - في دراسة إكلينيكية للمرضى المصابين بارتفاع ضغط الدم فعالية خافضة للضغط مماثلة لتلك الموجودة في إنالابريل مثبط الإنزيم المحول للأنجيوتنسين. أظهرت المزيد من الدراسات حول فعالية مضادات البطانة في ارتفاع ضغط الدم أهميتها السريرية في علاج ارتفاع ضغط الدم المقاوم والمخاطر القلبية الوعائية العالية. تم الحصول على هذه البيانات في تجربتين سريريتين كبيرتين DORADO (ن = 379) و DORADO-AC (ن = 849) ، حيث تمت إضافة darusentan إلى العلاج المركب الثلاثي في المرضى الذين يعانون من ارتفاع ضغط الدم المقاوم. في دراسة DORADO ، ارتبط مرضى ارتفاع ضغط الدم المقاوم مرض مزمنالكلى والبروتين ، نتيجة لإضافة darusentan ، لم يلاحظ فقط انخفاض كبير في ضغط الدم ، ولكن أيضًا انخفاض في إفراز البروتين. تم تأكيد التأثير المضاد للبروتين لمضادات مستقبلات الإندوثيلين لاحقًا في دراسة أجريت على المرضى الذين يعانون من: اعتلال الكلية السكريعند استخدام أفوسنتان. ومع ذلك ، في دراسة DORADO-AC ، لم تكن هناك ميزة في تقليل ضغط الدم الإضافي مقارنة بالمقارنات والعلاج الوهمي ، والذي كان سبب إنهاء المزيد من الدراسات. بالإضافة إلى ذلك ، في 4 دراسات كبيرة حول مضادات البطانة (bosentan ، darusentan ، enrasentan) في المرضى الذين يعانون من قصور القلب الاحتقاني ، تم الحصول على نتائج متضاربة ، والتي تم تفسيرها من خلال زيادة تركيز endothelin-1. تم تعليق مزيد من الدراسة لمضادات مستقبلات الإندوثيلين بسبب التأثيرات الضائرة المرتبطة باحتباس السوائل (الوذمة المحيطية ، زيادة الحجم). يرتبط تطور هذه التأثيرات بتأثير مضادات البطانة على مستقبلات النوع B ، مما أدى إلى تغيير البحث عن الأدوية التي تؤثر على نظام البطانة من خلال مسارات أخرى ؛ ومضادات مستقبلات الإندوثيلين حالياً لها مؤشر واحد فقط ، وهو علاج ارتفاع ضغط الدم الرئوي.
مع الأخذ في الاعتبار الأهمية الكبيرة لنظام البطانة في تنظيم نغمة الأوعية الدموية ، يجري البحث عن آلية أخرى للعمل من خلال vasopeptidase - EPF ، والتي تشارك في تكوين endothelin-1 النشط (الشكل 3). يمكن أن يؤدي منع الإنزيم المحول للأنجيوتنسين والجمع بين تثبيط NEP بشكل فعال إلى منع تكوين البطانة 1 وتقوية تأثيرات الببتيد الناتريوتريك. تتمثل مزايا آلية العمل المزدوجة ، من ناحية ، في منع عيوب مثبطات NEP المرتبطة بالتضيق الوعائي المحتمل بوساطة تنشيط البطانة ، ومن ناحية أخرى ، فإن النشاط الناتريوتريك لمثبطات NEP يجعل من الممكن تعويض احتباس السوائل المرتبطة بالحصار غير الانتقائي لمستقبلات البطانة. Daglutril هو مثبط مزدوج لـ NEP و EPF ، وهو في المرحلة الثانية من التجارب السريرية. وقد أظهرت الدراسات تأثيرات واضحة للقلب للدواء بسبب انخفاض في إعادة تشكيل القلب والأوعية الدموية ، وانحدار التضخم والتليف.
مثبطات الرينين المباشرة
من المعروف أن مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبلات ATII تزيد من نشاط الرينين عن طريق آلية التغذية الراجعة ، وهذا هو سبب الهروب من فعالية حاصرات RAAS. يمثل الرينين الخطوة الأولى في سلسلة RAAS ؛ يتم إنتاجه من قبل الخلايا المجاورة للكبيبات في الكلى. الرينين من خلال مولد الأنجيوتنسين يعزز تكوين ATII وتضيق الأوعية وإفراز الألدوستيرون ، كما ينظم آليات التغذية الراجعة. لذلك ، فإن تثبيط الرينين يسمح بتحقيق المزيد حصار كاملأنظمة RAAS. البحث عن مثبطات الرينين مستمر منذ السبعينيات. لفترة طويلةلم يكن من الممكن الحصول على شكل فموي من مثبطات الرينين بسبب قلة توافرها الحيوي في الجهاز الهضمي (أقل من 2٪). تم تسجيل أول مثبط الرينين المباشر المناسب للإعطاء عن طريق الفم ، أليسكيرين ، في عام 2007. أليسكرين لديه توافر بيولوجي منخفض (2.6٪) ، فترة كبيرةنصف عمر الإطراح (24-40 ساعة) ، طريق خارجي للتخلص. ترتبط الديناميكيات الدوائية للأليسكيرين بانخفاض بنسبة 80 ٪ في مستوى ATII. في الدراسات السريرية التي أجريت على مرضى ارتفاع ضغط الدم ، أدى تناول أليسكيرين بجرعات 150-300 مجم / يوم إلى انخفاض في ضغط الدم بنسبة 8.7-13 و14.1-15.8 ملم زئبق. على التوالي ، و DBP - بنسبة 7.8-10.3 و 10.3-12.3 ملم زئبق. . لوحظ التأثير الخافض لضغط الدم من aliskiren في مجموعات فرعية مختلفة من المرضى ، بما في ذلك المرضى الذين يعانون من متلازمة التمثيل الغذائي والسمنة. من حيث الشدة ، كان مشابهًا لتأثير مثبطات الإنزيم المحول للأنجيوتنسين ، وحاصرات مستقبلات ATII ، ولوحظ تأثير إضافي مع فالسارتان ، وهيدروكلوروثيازيد ، وأملوديبين. أظهر عدد من الدراسات السريرية تأثيرًا عضويًا للدواء: التأثير المضاد للبروتين في المرضى الذين يعانون من اعتلال الكلية السكري (دراسة AVOID ، ن = 599) ، انحدار تضخم البطين الأيسر في المرضى الذين يعانون من ارتفاع ضغط الدم (دراسة ALLAY ، ن = 465). وهكذا ، في دراسة AVOID ، بعد 3 أشهر من العلاج باستخدام اللوسارتان بجرعة 100 مجم / يوم والوصول إلى المستوى المستهدف لضغط الدم (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
بالإضافة إلى ذلك ، يتم إجراء سلسلة من الدراسات السريرية لألسكيرين في علاج أمراض القلب والأوعية الدموية الأخرى مع تقييم التأثير على تشخيص المرضى: ALOFT (ن = 320) ، أستروناوت (ن = 1639) ، ATMOSPHERE (ن = 7000) دراسات في المرضى الذين يعانون من قصور القلب الاحتقاني ، ودراسة ALTITUDE في المرضى الذين يعانون من داء السكري ومخاطر القلب والأوعية الدموية المرتفعة ، ودراسة ASPIRE في المرضى الذين يعانون من إعادة عرض ما بعد الاحتشاء.
خاتمة
لحل مشاكل الوقاية من أمراض القلب والأوعية الدموية ، يستمر إنشاء عقاقير جديدة بآلية عمل متعددة معقدة ، مما يسمح بحصار أكثر اكتمالا لـ RAAS من خلال سلسلة من آليات تنظيم الدورة الدموية والعصبية. لا تسمح التأثيرات المحتملة لمثل هذه الأدوية بتوفير تأثير إضافي خافض للضغط فحسب ، بل تتيح أيضًا التحكم في مستويات ضغط الدم لدى المرضى المعرضين لمخاطر عالية ، بما في ذلك ارتفاع ضغط الدم المقاوم. تظهر العقاقير ذات آلية العمل المتعددة مزايا في تأثيرها العضوي الواقي بشكل أكثر وضوحًا ، والذي سيمنع حدوث المزيد من الضرر لنظام القلب والأوعية الدموية. تتطلب دراسة فوائد الأدوية الجديدة التي تمنع RAAS مزيدًا من البحث والتقييم لتأثيرها على تشخيص المرضى الذين يعانون من ارتفاع ضغط الدم وأمراض القلب والأوعية الدموية الأخرى.


الأدب
1 كامبل دي. تثبيط Vasopeptidase: سيف ذو حدين؟ // ارتفاع ضغط الدم. 2003 المجلد. 41. ص 383-389.
2. Laurent S. ، Schlaich M. ، Esler M. الأدوية الجديدة والإجراءات والأجهزة لارتفاع ضغط الدم // لانسيت. 2012. المجلد. 380. ص 591-600.
3. Corti R.، Burnett JC، Rouleau J.L. وآخرون. مثبطات Vasopeptidase: مفهوم علاجي جديد في أمراض القلب والأوعية الدموية؟ // الدوران. 2001 المجلد. 104. ص 1856-1862.
4. Mangiafico S.، Costello-Boerrigter L.C.، Andersen I.A. وآخرون. تثبيط endopeptidase المحايد ونظام الببتيد الناتريوتريك: استراتيجية متطورة في علاجات القلب والأوعية الدموية // Eur. Heart J. 2012 ، دوى: 10.1093 / eurheartj / ehs262.
5. Rouleau J.L.، Pfeffer M.A.، Stewart D.J. وآخرون. مقارنة بين مثبطات vasopeptidase و omapatrilat و lisinopril على تحمل التمرين والمرض في مرضى قصور القلب: تجربة عشوائية IMPRESS // لانسيت. 2000 المجلد. 356. ص 615-620.
6. باكر إم ، كليف آر إم ، كونستام إم إيه. وآخرون. مقارنة بين omapatrilat و enalapril في المرضى الذين يعانون من قصور القلب المزمن: Omapatrilat vs Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002 المجلد. 106. ص 920-926.
7. Warner K.K.، Visconti J.A.، Tschampel M.M. حاصرات مستقبلات الأنجيوتنسين 2 في المرضى الذين يعانون من وذمة وعائية يسببها مثبط الإنزيم المحول للأنجيوتنسين // آن. فارماكوثر. 2000 المجلد. 34. ص 526-528.
8. Kostis J.B.، Packer M.، Black H.R. وآخرون. Omapatrilat و enalapril في المرضى الذين يعانون من ارتفاع ضغط الدم: محاكمة Omapatrilat القلب والأوعية الدموية مقابل Enalapril (OCTAVE) // Am. J. Hypertens. 2004 المجلد. 17. ص 103-111.
9. عزيزي م ، بيسري أ ، بيرارد س وآخرون. حركية الدواء والديناميكا الدوائية لمثبط فاسوببتيداز AVE7688 في البشر // كلين. فارماكول. هناك. 2006 المجلد. 79. ص 49-61.
10. جو جيه ، نوي أ ، شاندرا ب وآخرون. حركية الدواء والديناميكا الدوائية لـ LCZ696 ، مثبط جديد لمستقبلات الأنجيوتنسين مزدوج التأثير (ARNi) // J. Clin. فارماكول. 2010 المجلد. 50. ص 401-414.
11. Ruilope L.M. ، Dukat A. ، Buhm M. et al. تقليل ضغط الدم باستخدام LCZ696 ، مثبط جديد مزدوج التأثير لمستقبلات الأنجيوتنسين 2 والنيبريليسين: دراسة مقارنة عشوائية ، مزدوجة التعمية ، خاضعة للتحكم الوهمي ، // لانسيت. 2010 المجلد. 375. ص 1255-1266.
12. Solomon S.D. ، Zile M. ، Pieske B. et al. مثبط مستقبلات الأنجيوتنسين Neprilysin LCZ696 في قصور القلب مع جزء طرد محفوظ: تجربة عشوائية محكومة مزدوجة التعمية من المرحلة الثانية // لانسيت. 2012. المجلد. 380 (9851). ص 1387-1395.
13. ليفين إي. Endothelins // N. Engl. جيه ميد. 1995 المجلد. 333. ص 356-363.
14. Dhaun N.، Goddard J.، Kohan D.E. وآخرون. دور endothelin-1 في ارتفاع ضغط الدم السريري: 20 عامًا على // ارتفاع ضغط الدم. 2008 المجلد. 52. ص 452-459.
15. Burnier M. ، مضادات مستقبلات Forni V. Endothelin: مكان في إدارة ارتفاع ضغط الدم الأساسي؟ // نفرول. يتصل. زرع اعضاء. 2011.0: 1-4. دوى: 10.1093 / ndt / gfr704.
16. Krum H. ، Viskoper R.J. ، Lacourciere Y. et al. تأثير مضادات مستقبلات الإندوثيلين ، بوسنتان ، على ضغط الدم لدى مرضى ارتفاع ضغط الدم الأساسي. محققو ارتفاع ضغط الدم في بوسنتان // N. Engl. جيه ميد. 1998 المجلد. 338. ص 784-790.
17. ويبر إم إيه ، بلاك إتش ، باكريس جي وآخرون. مضاد انتقائي لمستقبلات الإندوثيلين لخفض ضغط الدم لدى المرضى الذين يعانون من ارتفاع ضغط الدم المقاوم للعلاج: تجربة عشوائية مزدوجة التعمية خاضعة للتحكم بالغفل // لانسيت. 2009 المجلد. 374 ص 1423-1431.
18. بكريس ج.ل ، ليندولم إل إتش ، بلاك H.R. وآخرون. نتائج متباينة باستخدام ضغط الدم في العيادة وضغط الدم المتنقل: تقرير عن تجربة ارتفاع ضغط الدم المقاوم لداروسينتان // ارتفاع ضغط الدم. 2010 المجلد. 56. ص 824-830.
19. Mann J.F. ، Green D. ، Jamerson K. et al. Avosentan لاعتلال الكلية السكري الصريح // J. Am. soc. نفرول. 2010 المجلد. 21. ص 527-535.
20. Kalk P. ، Sharkovska Y. ، Kashina E. et al. يمنع الإنزيم المحول البطاني / مثبط الإندوببتيداز المحايد SLV338 إعادة تشكيل القلب الناتج عن ارتفاع ضغط الدم بطريقة مستقلة عن ضغط الدم // ارتفاع ضغط الدم. 2011 المجلد. 57. ص 755-763.
21. Nussberger J. ، Wuerzner G. ، Jensen C. et al. قمع أنجيوتنسين 2 في البشر بواسطة مثبط الرينين النشط نظريًا أليسكيرين (SPP100): مقارنة مع إنالابريل // ارتفاع ضغط الدم. 2002 المجلد. 39 (1). P.E1-8.
22. Alreja G. ، Joseph J. Renin وأمراض القلب والأوعية الدموية: مسار مهتر أم اتجاه جديد؟ // العالم J. Cardiol. 2011 المجلد. 3 (3). ص 72-83.
23. Ingelfinger J.R. Aliskiren والعلاج المزدوج في داء السكري من النوع 2 // N. Engl. جيه ميد. 2008 المجلد. 358 (23). ص 2503-2505.
24. Pouleur A.C.، Uno H.، Prescott M.F.، Desai A. (for the ALLAY Investigates). يؤدي قمع الألدوستيرون إلى تراجع تضخم البطين الأيسر في المرضى الذين يعانون من ارتفاع ضغط الدم // J.Renin-Angiotensin-Aldosterone System. 2011 المجلد. 12. ص 483-490.
25. Kelly D. J.، Zhang Y.، Moe G. et al. Aliskiren ، مثبط الرينين الجديد ، هو واقي كلوي في نموذج اعتلال الكلية السكري المتقدم في الفئران // ديابيتول. 2007 المجلد. 50. ص 2398-2404.
يلعب دورًا مركزيًا في تطور ارتفاع ضغط الدم الكلوي. أي تلف لحمة الكلى (تصلب ، خراجات ، تندب ، آفات اعتلال الأوعية الدقيقة ، التهاب أنبوبي خلالي أو التهاب كبيبي) يسبب ضعف التروية الكبيبية ويزيد من إفراز الرينين.
يؤدي فرط رينين الدم إلى تضيق الأوعية المعتمد على الأنجيوتنسين 2 وكذلك احتباس الصوديوم المعتمد على الألدوستيرون. وهكذا ، فإن الإجمالي المقاومة المحيطيةوحجم الدم المنتشر. في 90٪ من مرضى الداء الكلوي بمراحله الأخيرة ، يعتمد AH على الحجم ، وفي 10٪ يكون العامل الرئيسي هو زيادة نشاط RAS. بالإضافة إلى ذلك ، تؤدي المستويات العالية من أنجيوتنسين 2 إلى حدوث التهاب وتضخم عضلة القلب وتلف بطانة الأوعية وتكاثر خلايا ميسانجيل والتليف الخلالي.
له تأثير كبير على حجم السائل خارج الخلية وضغط الدم بسبب تناول الصوديوم مع الطعام بشكل غير متحكم فيه. قد يكون احتباس الصوديوم في CKD ناتجًا عن كل من انخفاض GFR وزيادة في إعادة امتصاصه في الأنابيب ، بشكل مستقل ومستقل عن تنشيط RAAS (في التهاب كبيبات الكلى مع المتلازمة الكلوية).
في الأطفال المصابين بارتفاع ضغط الدم الذين يخضعون لغسيل الكلى ، يكون إدرار البول عادة أقل منه في المرضى العاديين من نفس العمر ، كما أن زيادة الوزن بين التحاليل ترتبط بشكل معتدل بزيادة ضغط الدم بين الخلايا (r = 0.41). يقلل استئصال الكلية في الأطفال المصابين بارتفاع ضغط الدم المعتمد على الرينين من متوسط ضغط الدم ، ويصبح ارتفاع ضغط الدم معتمدًا على الحجم.
تتمثل إحدى الآليات المهمة لارتفاع ضغط الدم في زيادة نشاط الجهاز العصبي الودي ، وهو ما يُلاحظ في المرضى الذين يعانون من مرض الكلى المزمن وخاصة في مرض الكلى المزمن. الآليات الكامنة وراء هذه الظاهرة ليست واضحة بعد وقد تشمل إشارات واردة من الكلى واضطرابات الدوبامين وتراكم اللبتين. ليس فقط الحصار المفروض على مستقبلات بيتا ، ولكن أيضًا تثبيط الإنزيم المحول للأنجيوتنسين (ACE) يمكن أن يقلل من فرط النشاط الودي في مرض الكلى المزمن. يبدو أن نقص التروية الكلوية من أي أصل (بما في ذلك موضعي) يسبب فرط النشاط الودي.
الأدوية المستخدمة في علاج مرضى الكلى المزمن يمكن أن تسبب ارتفاع ضغط الدم الشرياني علاجي المنشأ. على سبيل المثال ، يؤدي استخدام إرثروبويتين لعدة أسابيع إلى ارتفاع ضغط الدم لدى 20٪ من المرضى. تسبب القشرانيات السكرية احتباس السوائل بسبب نشاط القشرانيات المعدنية. يتسبب السيكلوسبورين أ في زيادة الشرايين الكبيبية الواردة وتضخم الجهاز المجاور للكبيبات ، يليها زيادة إفراز الرينين والأنجيوتنسين II.
وبالتالي ، فإن جميع الأطفال المصابين بمرض الكلى المزمن معرضون لخطر الإصابة بمرض AH. تشمل المجموعة عالية الخطورة المرضى الذين يعانون من الداء الكلوي بمراحله الأخيرة ، ومتلقي زرع الكلى ، والمرضى الذين يعانون من التهاب كبيبات الكلى سريع التقدم.
يعد التشخيص المبكر لارتفاع ضغط الدم مهمة بالغة الأهمية لمنع الآثار طويلة المدى لارتفاع ضغط الدم. لهذا الغرض ، من الضروري استخدام طرق الفحص النشطة ، حيث غالبًا ما تكون الأعراض السريرية لارتفاع ضغط الدم غائبة.
إن أبسط طريقة للكشف عن ارتفاع ضغط الدم هي القياس المنتظم لضغط الدم ، على الأقل عند كل فحص يقوم به الطبيب للمريض. يكون تشخيص ارتفاع ضغط الدم صحيحًا إذا كانت 3 قياسات سريرية على الأقل لضغط الدم أعلى من 95 بالمائة بالنسبة للعمر والطول. (المرفق 1.). حاليًا ، أصبحت طريقة مراقبة ضغط الدم (ABPM) على مدار 24 ساعة (يوميًا) منتشرة على نطاق واسع.
تسمح لك هذه الدراسة بتشخيص "ارتفاع ضغط الدم الخفي" ، أي لا يمكن اكتشافه من خلال قياسات سريرية واحدة لضغط الدم ، على سبيل المثال ، في الليل ، استبعاد ارتفاع ضغط الدم المعطف الأبيض ، والذي يحدث حتى عند الأطفال الذين يقيمون في المستشفى لفترة طويلة. في الحالة الأخيرة ، يُنصح بإجراء ABPM في العيادة الخارجية ، عندما يكون الطفل في بيئته المنزلية المعتادة طوال فترة الدراسة.
يشار إلى ABPM لجميع الأطفال المصابين بمرض الكلى المزمن سنويًا. إذا تم الكشف عن ارتفاع ضغط الدم ، فمن الضروري أيضًا إجراء فحص طب العيون (لتقييم حالة الأوعية الشبكية) وتخطيط صدى القلب (لاستبعاد الاختلال الوظيفي الانقباضي والانبساطي ، وتقييم درجة تضخم عضلة القلب). في المستقبل ، يجب إجراء هذه الدراسات مرة واحدة على الأقل في السنة.
الهدف الرئيسي من العلاج الخافض للضغط هو منع تلف الأعضاء المستهدفة (خاصة تضخم البطين الأيسر) وإبطاء تقدم مرض الكلى المزمن. يشار إلى جميع الأطفال المصابين بمرض الكلى المزمن المعقد بسبب ارتفاع ضغط الدم للعلاج الخافض للضغط حتى تكون مستويات ضغط الدم أقل من 90 في المائة بالنسبة للعمر والطول.
يشمل علاج ارتفاع ضغط الدم أسلوب الحياة وتعديلات النظام الغذائي والعلاج من تعاطي المخدرات.
في النظام الغذائي للأطفال المصابين بمرض الكلى المزمن المعقد بسبب ارتفاع ضغط الدم ، أولاً وقبل كل شيء ، من الضروري الحد من تناول الصوديوم إلى 1-2 جرام / يوم. يتم تحضير الطعام بدون إضافة الملح ، والذي يتم صرفه بجرعات لإضافة الملح إلى الطعام على طبق ؛ يجب استبعاد جميع الأطعمة التي تحتوي على نسبة عالية من الصوديوم (الأطعمة المعلبة ، النقانق ، خبز الجاودار ، إلخ). غالبًا ما يصعب على المرضى تحمل مثل هذه القيود ، لكن تناول الصوديوم غير المنضبط يقلل بشكل كبير من فعالية العلاج بالعقاقير الخافضة للضغط.
السمنة ليست شائعة عند الأطفال المصابين بمرض الكلى المزمن وعادة ما ترتبط بعلاج الستيرويد. يساهم الانخفاض التدريجي في وزن الجسم على خلفية اتباع نظام غذائي منخفض السعرات الحرارية ونشاط بدني بجرعات في تطبيع ضغط الدم. من الناحية العملية ، من الصعب تنفيذ نظام غذائي منخفض السعرات الحرارية بسبب القيود الغذائية الموجودة بالفعل لدى الأطفال المصابين بمرض الكلى المزمن ، ونادرًا ما يكون فعالًا. ومع ذلك ، في الأطفال الذين يعانون من السمنة المفرطة مع احتباس الصوديوم ، قد يكون اتباع نظام غذائي منخفض السعرات الحرارية ومنخفض الصوديوم مفيدًا.
في مرضى ارتفاع ضغط الدم الذين يتلقون العلاج الإشعاعي الانتقائي ، قد يؤدي تغيير نظام غسيل الكلى إلى تحسين التحكم في ضغط الدم قبل بدء العلاج الدوائي. في معظم الحالات ، يمكن تحقيق تطبيع ضغط الدم في مرضى غسيل الكلى من خلال مدة كافية من غسيل الكلى ، والتحكم الدقيق في توازن السوائل خارج الخلية ، وتحقيق الوزن الجاف بشكل أكثر قوة. يُعتقد أن تقليل الصوديوم الغذائي جنبًا إلى جنب مع انخفاض الصوديوم في غسيل الكلى يمكن مقارنته في الفعالية بزيادة وقت غسيل الكلى ويمكن أن يؤدي إلى انخفاض متواضع في ضغط الدم.
في جميع مراحل مرض الكلى المزمن ، أساس العلاج الخافض للضغط هو العلاج الدوائي. يمكن تحقيق التحكم في ضغط الدم دون النسبة المئوية التسعين من خلال العلاج الأحادي في ما لا يزيد عن 75٪ من الأطفال المصابين بالمرحلة الثانية من مرض الكلى المزمن. يحتاج المرضى الآخرون إلى استخدام عقارين أو أكثر. في الأطفال الذين يعانون من الداء الكلوي بمراحله الأخيرة ، من الصعب تحقيق السيطرة الكافية على ضغط الدم ، و 50 ٪ من الأطفال الذين يخضعون لغسيل الكلى يعانون من ارتفاع ضغط الدم غير المنضبط.
في الأطفال المصابين بارتفاع ضغط الدم ، يوصى ببدء العلاج بدواء واحد بجرعة علاجية منخفضة أو معتدلة ثم زيادته تدريجيًا حتى يتم التحكم في ضغط الدم. في حالة عدم وجود تأثير كافٍ للعلاج الأحادي ، يشار إلى استخدام مزيج من 2 أو أكثر من الأدوية. الاستثناء هو الحالات الطارئة في ارتفاع ضغط الدم ، مثل أزمة ارتفاع ضغط الدم ، واعتلال الدماغ الناتج عن ارتفاع ضغط الدم ، عندما يجب أن يبدأ العلاج بإعطاء الأدوية عن طريق الوريد حتى يتحقق التأثير السريري.
حاليًا ، تُستخدم مجموعة كبيرة من الأدوية في علاج ارتفاع ضغط الدم الشرياني (الجدول 2.1).
بادئ ذي بدء ، يتم استخدام عقاقير المجموعات التالية:
مثبطات الإنزيم المحول للأنجيوتنسين (مثبطات الإنزيم المحول للأنجيوتنسين)
حاصرات مستقبلات الأنجيوتنسين 2 (ARBs)
محصرات قنوات الكالسيوم
β- حاصرات
مدرات البول
تشمل الأدوية الاحتياطية:
α β - حاصرات
مناهضات ألفا المركزية
مضادات ألفا المحيطية
موسعات الأوعية المحيطية.
في الأطفال المصابين بمرض كلوي مزمن ، من الأكثر منطقية أن يبدأ العلاج بمثبطات الإنزيم المحول للأنجيوتنسين أو ARB. هذه الأدوية ليس لها تأثير خافض للضغط فحسب ، بل تبطئ أيضًا تطور الفشل الكلوي بشكل أكثر فاعلية من أدوية المجموعات الدوائية الأخرى. يرجع التأثير الوقائي للكلية لحصار RAAS إلى انخفاض في ارتفاع ضغط الدم داخل الكبيبة من خلال التوسيع الانتقائي للشريان الصادر ، وانخفاض في بروتينية ، وإضعاف عمل أنجيوتنسين 2 المؤيد للالتهابات والتصلب. التأثير الإضافي لحصار RAAS هو الحد من فرط النشاط الودي.
نظرًا لأن البروتينية هي عامل مستقل في تطور مرض الكلى المزمن ، يجب أن يتلقى المرضى المصابون بمرض الكلى المزمن والبيلة البروتينية حاصرات RAAS حتى في حالة عدم وجود ارتفاع ضغط الدم. لم تكن هناك فائدة واضحة لاستخدام حاصرات مستقبلات الأنجيوتنسين على مثبطات الإنزيم المحول للأنجيوتنسين. إذا استمرت البيلة البروتينية في العلاج الأحادي ، فيمكن اعتبار مزيج من مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبل الأنجيوتنسين ، لأن هذا المزيج فعال في تقليل البيلة البروتينية وإبطاء تقدم مرض الكلى المزمن.
يُمنع استخدام مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبل الأنجيوتنسين في المرضى الذين يعانون من انخفاض في معدل الترشيح الكبيبي (GFR) 20 مل / دقيقة ، مع فرط بوتاسيوم الدم ، وتضيق الشريان الكلوي الثنائي. عند وصف هذه المجموعات من الأدوية للأطفال المصابين بالمرحلة 3-4 CKD ، من الضروري التحكم في مستوى الآزوتيميا والبوتاسيوم بعد بدء العلاج ومع كل زيادة في الجرعة. يزيد العلاج بمزيج من مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبل الأنجيوتنسين من خطر انخفاض معدل الترشيح الكبيبي وفرط بوتاسيوم الدم. في الأطفال الذين يعانون من الفشل الكلوي المزمن ، قد يكون من المستحسن استخدام فوسينوبريل (مونوبريل) ، لأن. يتم استقلاب هذا الدواء (على عكس الأدوية الأخرى والإنزيم المحول للأنجيوتنسين) بشكل رئيسي في الكبد ، ولا يتم إفرازه في البول وهو أكثر أمانًا للمرضى الذين يعانون من ضعف كبير في وظائف الكلى. ويلاحظ أن السعال الناجم عن الإنزيم المحول للأنجيوتنسين عند الأطفال أقل شيوعًا منه لدى البالغين ؛ إذا حدث هذا التأثير الجانبي ، فمن الممكن استبدال مثبطات الإنزيم المحول للأنجيوتنسين بـ ARB.
حاصرات ب هي أدوية الخط الثاني لعلاج الأطفال المصابين بارتفاع ضغط الدم الكلوي. يجب استخدام حاصرات بيتا بحذر في حالات قصور القلب ومرضى السكري بسبب التأثيرات الأيضية السلبية. يمنع استخدام حاصرات ب غير الانتقائية في أمراض الرئة المصحوبة بانسداد الشعب الهوائية. عند الرضع ، بروبرانولول له تأثير جيد. يتيح لك الشكل المتخلف من هذا الدواء وصفه مرة واحدة يوميًا للأطفال الأكبر سنًا. من الأفضل وصف حاصرات b1 الانتقائية ، مثل أتينولول ، والتي لها أيضًا تأثير طويل الأمد.
يشار إلى استخدام حاصرات ب في وجود أعراض فرط نشاط الجهاز العصبي الودي: عدم انتظام دقات القلب ، وتضيق الأوعية ، وارتفاع معدل ضربات القلب.
تستخدم حاصرات قنوات الكالسيوم (CCBs) كعلاج مساعد في الأطفال المصابين بارتفاع ضغط الدم المقاوم. تعمل أدوية ديهيدروبيريدين (نيفيديبين ، أملوديبين ، إلخ) بشكل أساسي كموسعات للأوعية. جرعات أملوديبين مصممة لطب الأطفال ولا تتطلب تعديلًا اعتمادًا على وظيفة الكلى ، ومع ذلك ، فإن ثنائي هيدروبيريدين CCBs (نيفيديبين) يزيد الضغط داخل الكُبيبة وقد يزيد من البيلة البروتينية ، وبالتالي ، دون أن يكون له تأثير واق كلوي. تحتوي CCBs غير ثنائي هيدروبيريدين (مشتقات فينيل ألكيلامين - فيراباميل ، بنزوديازيبين - ديلتيازيم) على تأثير إضافي مضاد للبروتينات.
في الدراسات التي أجريت على المرضى المسنين المصابين بداء السكري من النوع 2 ، أظهرت CCBs غير الديجروبيريدين أنها فعالة في تقليل البيلة البروتينية وضغط الدم وإبطاء تقدم CKD ، كانت فعاليتها في هذا الصدد مماثلة لمثبط الإنزيم المحول للأنجيوتنسين - ليسينوبريل. نظرًا لعدم إجراء مثل هذه الدراسات بين الأطفال ، يجب استخدام CCBs بدون ديجروبريدين بحذر في مرحلة الطفولة ، نظرًا لآثارها الجانبية (إطالة فترة PQ ، بطء ضربات القلب).
في الدراسات التي أجريت على مرضى السكري وارتفاع ضغط الدم والبيلة البروتينية ، كان للجمع بين مثبطات الإنزيم المحول للأنجيوتنسين مع الجيل الثالث من ثنائي هيدروبيريدين CCB ، مانيديبين ، تأثير إضافي مضاد للبروتين مقارنة بالعلاج الأحادي لمثبط الإنزيم المحول للأنجيوتنسين. تم عرض التأثير المفيد للمانيديبين على ديناميكا الدم الكلوية والبروتينية.
نيكارديبين عن طريق الوريد هو العلاج المفضل لعلاج أزمة ارتفاع ضغط الدم ، خاصة عندما تكون وظيفة الكلى غير معروفة أو تتغير بسرعة. يمكن استخدام هذا الدواء بأمان حتى عند الأطفال الصغار جدًا المصابين بارتفاع ضغط الدم.
تُوصف مدرات البول بشكل أساسي للمرضى الذين يعانون من احتباس الصوديوم وفرط حجم الدم والوذمة ، وهي ليست أدوية الخط الأول في علاج ارتفاع ضغط الدم لدى الأطفال المصابين بمرض الكلى المزمن. يجب أن نتذكر أن مدرات البول الثيازيدية تصبح غير فعالة في GFR.
نظام الرينين-أنجيوتنسين-الألدوستيرون (RAAS) له تأثير خلطي مهم على نظام القلب والأوعية الدموية ويشارك في تنظيم ضغط الدم. العنصر المركزي في RAAS هو أنجيوتنسين 2 (AT II) (مخطط 1) ، الذي له تأثير قوي مباشر على تضيق الأوعية بشكل رئيسي على الشرايين وتأثير وسيط على الجهاز العصبي المركزي ، وإطلاق الكاتيكولامينات من الغدد الكظرية ويسبب زيادة مقاومة الأوعية الدموية الطرفية ، ويحفز إفراز الألدوستيرون ويؤدي إلى احتباس السوائل وزيادة (BCC) ، ويحفز إطلاق الكاتيكولامينات (النوربينفرين) وغيرها من الهرمونات العصبية من النهايات المتعاطفة. يتم تأثير AT II على مستوى ضغط الدم بسبب التأثير على توتر الأوعية الدموية ، وكذلك من خلال إعادة الهيكلة الهيكلية وإعادة تشكيل القلب والأوعية الدموية. على وجه الخصوص ، ATII هو أيضًا عامل نمو (أو معدل نمو) لخلايا عضلة القلب وخلايا العضلات الملساء الوعائية.
مخطط 1. هيكل نظام الرينين - أنجيوتنسين - الألدوستيرون
وظائف الأشكال الأخرى للأنجيوتنسين. أنجيوتنسين 1 ليس له أهمية تذكر في نظام RAAS ، حيث يتحول بسرعة إلى ATP ، بالإضافة إلى أن نشاطه يقل 100 مرة عن نشاط ATP. يعمل أنجيوتنسين 3 مثل ATP ، لكن نشاطه الضاغط أضعف بأربع مرات من ATP. يتكون أنجيوتنسين 1-7 نتيجة تحويل الأنجيوتنسين 1. من حيث الوظائف ، يختلف اختلافًا كبيرًا عن ATP: فهو لا يسبب تأثيرًا ضاغطًا ، ولكن على العكس من ذلك ، يؤدي إلى انخفاض في ضغط الدم بسبب إفراز هرمون ADH ، وتحفيز تخليق البروستاجلاندين ، وتبول ناتري.
RAAS له تأثير تنظيمي على وظائف الكلى. يسبب ATP تشنجًا قويًا للشريان الوارد وانخفاض الضغط في الشعيرات الدموية في الكبيبة ، وانخفاض في الترشيح في النيفرون. نتيجة لانخفاض الترشيح ، ينخفض إعادة امتصاص الصوديوم في النيفرون القريب ، مما يؤدي إلى زيادة تركيز الصوديوم في الأنابيب البعيدة وتنشيط مستقبلات الصوديوم الحساسة في تعداد البقعة في النيفرون. وفقًا لآلية التغذية الراجعة ، يترافق ذلك مع تثبيط إطلاق الرينين وزيادة معدل الترشيح الكبيبي.
يرتبط عمل RAAS بالألدوستيرون ومن خلال آلية التغذية الراجعة. الألدوستيرون هو أهم منظم لحجم السائل خارج الخلية وتوازن البوتاسيوم. ليس للألدوستيرون تأثير مباشر على إفراز الرينين و ATP ، لكن التأثير غير المباشر ممكن من خلال احتباس الصوديوم في الجسم. يشارك ATP والإلكتروليتات في تنظيم إفراز الألدوستيرون ، مع تحفيز ATP ، ويقلل الصوديوم والبوتاسيوم من تكوينه.
يرتبط توازن الكهارل ارتباطًا وثيقًا بنشاط RAAS. لا يؤثر الصوديوم والبوتاسيوم على نشاط الرينين فحسب ، بل يغيران أيضًا حساسية الأنسجة لـ ATP. في الوقت نفسه ، يلعب الصوديوم دورًا كبيرًا في تنظيم نشاط الرينين ، وللبوتاسيوم والصوديوم نفس التأثيرات في تنظيم إفراز الألدوستيرون.
لوحظ التنشيط الفسيولوجي لـ RAAS مع فقدان الصوديوم والسوائل ، وانخفاض كبير في ضغط الدم ، مصحوبًا بانخفاض ضغط الترشيح في الكلى ، وزيادة نشاط الجهاز العصبي الودي ، وأيضًا تحت تأثير العديد من العوامل الخلطية (الفازوبريسين ، الهرمون الأذيني المدر للصوديوم ، الهرمون المضاد لإدرار البول).
يمكن أن يساهم عدد من أمراض القلب والأوعية الدموية في التحفيز المرضي لـ RAAS ، على وجه الخصوص ، في ارتفاع ضغط الدم ، وفشل القلب الاحتقاني ، واحتشاء عضلة القلب الحاد.
من المعروف الآن أن RAS لا يعمل فقط في البلازما (وظيفة الغدد الصماء) ، ولكن أيضًا في العديد من الأنسجة (الدماغ وجدار الأوعية الدموية والقلب والكلى والغدد الكظرية والرئتين). يمكن أن تعمل أنظمة الأنسجة هذه بشكل مستقل عن البلازما ، على المستوى الخلوي (تنظيم paracrine). لذلك ، هناك تأثيرات قصيرة المدى لـ ATII ، ناتجة عن جزءه المنتشر بحرية في الدورة الدموية الجهازية ، وتأخير التأثيرات ، التي يتم تنظيمها من خلال الأنسجة RAS والتأثير على آليات التكيف الهيكلي لتلف الأعضاء.
الإنزيم الرئيسي لـ RAAS هو الإنزيم المحول للأنجيوتنسين (ACE) ، والذي يضمن تحويل ΑTI إلى ATII. الكمية الرئيسية من ACE موجودة في الدوران الجهازي ، مما يوفر تشكيل ATII المتداول والتأثيرات الجيوديناميكية قصيرة المدى. يمكن إجراء تحويل AT إلى ATII في الأنسجة ليس فقط بمساعدة ACE ، ولكن أيضًا مع الإنزيمات الأخرى (chymases ، endoperoxides ، cathepsin G ، إلخ) ؛ يعتقدون أنهم يلعبون دورًا رائدًا في عمل الأنسجة RAS وتطوير التأثيرات طويلة المدى لنمذجة وظيفة وهيكل الأعضاء المستهدفة.
إن الإنزيم المحول للأنجيوتنسين مماثل لإنزيم كينيناز II المتورط في تحلل البراديكينين. براديكينين هو موسع وعائي قوي يشارك في تنظيم دوران الأوعية الدقيقة ونقل الأيونات. يتمتع براديكينين بعمر قصير جدًا وهو موجود في مجرى الدم (الأنسجة) بتركيزات منخفضة ؛ لذلك ستظهر آثاره كهرمون محلي (باراكرين). يعزز Bradykinin زيادة في Ca 2 + داخل الخلايا ، وهو عامل مساعد لـ NO synthetase تشارك في تكوين عامل استرخاء البطانة (أكسيد النيتريك أو NO). عامل استرخاء البطانة ، الذي يمنع تقلص العضلات الوعائية وتجمع الصفائح الدموية ، هو أيضًا مثبط للانقسام وتكاثر العضلات الملساء الوعائية ، مما يوفر تأثيرًا مضادًا لتصلب الشرايين. كما يحفز براديكينين تخليق البطانة الوعائية لـ PGE2 و PGI2 (البروستاسكلين) - موسعات الأوعية القوية وعوامل مضادة للصفيحات الدموية.
وبالتالي ، فإن البراديكينين ونظام الأقارب بأكمله مضادان لـ RAAS. يحتمل أن يؤدي منع الإنزيم المحول للأنجيوتنسين إلى زيادة مستوى الأقارب في أنسجة القلب وجدار الأوعية الدموية ، مما يوفر تأثيرات مضادة للتكاثر ، ومضادة للاكتئاب ، ومضادة للتطور ، ومضادة للصفيحات. يساهم الكينين في زيادة تدفق الدم وإدرار البول وإدرار البول دون حدوث تغيير كبير في معدل الترشيح الكبيبي. PG E2 و PGI2 لهما أيضًا تأثيرات مدر للبول ومدر للبول وتزيد من تدفق الدم الكلوي.
نظام الرينين - أنجيوتنسين - الألدوستيرون (RAAS.)
يشارك الجهاز المجاور للكبيبات (JGA) في تنظيم حجم الدم وضغطه. إن إنزيم الرينين المحلل للبروتين المتكون في حبيبات خلايا JGA يحفز تحويل مولد الأنجيوتنسين (أحد بروتينات البلازما) إلى أنجيوتنسين 1 ديكاببتيد ، والذي ليس له نشاط ضاغط. تحت تأثير الإنزيم المحول للأنجيوتنسين (ACE) ، يتم تكسيره (بشكل رئيسي في الرئتين والكلى والدماغ) إلى أنجيوتنسين 2 أوكتاببتيد ، والذي يعمل كمضيق للأوعية قوي ، ويحفز أيضًا إنتاج الألدوستيرون من قشرة الغدة الكظرية. يعزز الألدوستيرون إعادة امتصاص الصوديوم في أنابيب الكلى ويحفز إنتاج الهرمون المضاد لإدرار البول. نتيجة لذلك ، هناك احتباس في الصوديوم والماء ، مما يؤدي إلى زيادة ضغط الدم. بالإضافة إلى ذلك ، تحتوي بلازما الدم على أنجيوتنسين 3 (هيبتابيبتيد لا يحتوي على حمض الأسبارتيك) ، والذي يحفز أيضًا بشكل نشط إطلاق الألدوستيرون ، ولكن له تأثير ضغط أقل وضوحًا من أنجيوتنسين 2. وتجدر الإشارة إلى أنه كلما تم تكوين المزيد من الأنجيوتنسين II ، كلما كان تضيق الأوعية أكثر وضوحًا ، وبالتالي ، زادت زيادة ضغط الدم بشكل أكثر وضوحًا.
يتم تنظيم إفراز الرينين من خلال الآليات التالية ، والتي لا تستبعد بعضها البعض:
- 1) مستقبلات الضغط في الأوعية الكلوية ، والتي من الواضح أنها تستجيب للتغيرات في توتر جدار الشرايين الواردة ،
- 2) مستقبلات البقعة العميقة ، والتي تبدو حساسة للتغيرات في معدل دخول أو تركيز كلوريد الصوديوم في الأنابيب البعيدة ،
- 3) ردود فعل سلبية بين تركيز الأنجيوتنسين في الدم وإفراز الرينين
- 4) الجهاز العصبي الودي الذي يحفز إفراز الرينين نتيجة تنشيط مستقبلات بيتا الأدرينالية في العصب الكلوي.
نظام صيانة توازن الصوديوم. ويشمل معدل الترشيح الكبيبي (GFR) وعوامل التبول الداخلي (إفراز أيونات الصوديوم في البول). مع انخفاض في BCC ، يتناقص GFR أيضًا ، مما يؤدي بدوره إلى زيادة إعادة امتصاص الصوديوم في النيفرون القريب. تشمل عوامل التبول الطبيعي مجموعة من الببتيدات ذات الخصائص المتشابهة واسم شائع - الببتيد الناتريوتريك (أو الببتيد الأذيني) الذي تنتجه عضلة القلب الأذيني استجابة لتوسعها. تأثير أتريوببتيد هو تقليل إعادة امتصاص الصوديوم في الأنابيب البعيدة وتوسع الأوعية.
يشمل نظام المواد الكابحة للأوعية الكلوية: البروستاجلاندين ، نظام كاليكرين كينين ، NO ، عامل تنشيط الصفائح الدموية ، والذي من خلال عملها يوازن تأثير ضغط الأوعية لأنجيوتنسين.
بالإضافة إلى ذلك ، تلعب العوامل البيئية دورًا معينًا في ظهور ارتفاع ضغط الدم (الشكل 1 نقطة 6) ، مثل الخمول البدني ، والتدخين ، والإجهاد المزمن ، والاستهلاك المفرط للملح مع الطعام.
مسببات ارتفاع ضغط الدم الشرياني:
أسباب ارتفاع ضغط الدم الأساسي أو الأساسي غير معروفة. ومن غير المحتمل أن يفسر سبب واحد مثل هذه المجموعة المتنوعة من اضطرابات الدورة الدموية والفيزيولوجيا المرضية التي لوحظت في هذا المرض. في الوقت الحالي ، يلتزم العديد من المؤلفين بنظرية الفسيفساء لتطور ارتفاع ضغط الدم ، والتي بموجبها يعود الحفاظ على ارتفاع ضغط الدم إلى مشاركة العديد من العوامل ، حتى لو كان أي واحد منهم يسيطر في البداية (على سبيل المثال ، تفاعل المتعاطفين الجهاز العصبي ونظام الرينين - أنجيوتنسين - الألدوستيرون).
ليس هناك شك في أن هناك استعدادًا وراثيًا لارتفاع ضغط الدم ، لكن آليته الدقيقة لا تزال غير واضحة. من الممكن أن يكون للعوامل البيئية (مثل كمية الصوديوم في الطعام والنظام الغذائي ونمط الحياة التي تساهم في السمنة والإجهاد المزمن) تأثير فقط على الأفراد المهيئين وراثيًا.
الأسباب الرئيسية لتطور ارتفاع ضغط الدم الأساسي (أو ارتفاع ضغط الدم الأساسي) ، والتي تمثل 85-90 ٪ من جميع حالات ارتفاع ضغط الدم ، هي كما يلي:
- - تنشيط نظام الرينين - أنجيوتنسين - الألدوستيرون مع التغيرات في الجينات التي ترمز إلى مولد الأنجيوتنسين أو بروتينات RAAS الأخرى ،
- - تنشيط الجهاز العصبي الودي مما يؤدي إلى زيادة ضغط الدم بشكل رئيسي من خلال تضيق الأوعية.
- - انتهاك نقل الصوديوم عبر الأغشية الخلوية لخلايا العضلات الملساء للأوعية الدموية (نتيجة لتثبيط مضخة Na + -K + أو زيادة نفاذية الغشاء لـ Na + مع زيادة محتوى Ca2 + داخل الخلايا ) ،
- - نقص موسعات الأوعية (مثل أكسيد النيتروجين ، ومكونات نظام كاليكرين كينين ، والبروستاجلاندين ، وعامل التغذية الأذيني ، وما إلى ذلك).
من بين الأسباب الرئيسية لارتفاع ضغط الدم المصحوب بأعراض ما يلي:
- - تلف الكلى الثنائي الأولي (الذي قد يكون مصحوبًا بارتفاع ضغط الدم بسبب كل من زيادة إفراز الرينين وتنشيط RAAS مع احتباس الصوديوم والسوائل ، وانخفاض إفراز موسعات الأوعية) في أمراض مثل التهاب كبيبات الكلى الحاد والمزمن والتهاب الحويضة والكلية المزمن وتكيس الكلى المرض ، الداء النشواني ، أورام الكلى ، اعتلال المسالك البولية الانسدادي ، داء الكولاجين ، إلخ.
- - أمراض الغدد الصماء (التي يمكن علاجها) ، مثل فرط الألدوستيرونية الأولي والثانوي ، ومرض ومتلازمة إيتسينكو كوشينغ ، وتضخم الغدة الدرقية المنتشر (مرض بازيرو أو داء جريفز) ، ورم القواتم ، وأورام الكلى المنتجة للرينين.
- - الأمراض العصبية ، بما في ذلك تلك المصحوبة بارتفاع الضغط داخل الجمجمة (الصدمة ، الورم ، الخراج ، النزف) ، تلف منطقة ما تحت المهاد وجذع الدماغ ، المرتبطة بعوامل نفسية المنشأ.
- - أمراض الأوعية الدموية (التهاب الأوعية الدموية ، تضيق الشريان الأورطي والتشوهات الوعائية الأخرى) ، كثرة الحمر ، زيادة BCC ذات طبيعة علاجي المنشأ (مع النقل المفرط لمنتجات الدم والمحاليل).
مورفولوجيا ارتفاع ضغط الدم الشرياني:
شكل حميد من ارتفاع ضغط الدم:
في المراحل المبكرة من ارتفاع ضغط الدم ، لا يمكن اكتشاف أي تغييرات هيكلية. في النهاية ، يتطور التصلب الشرياني المعمم.
بالنظر إلى المسار الطويل للمرض ، هناك ثلاث مراحل لها اختلافات شكلية معينة وتتوافق مع المراحل التي اقترحها خبراء منظمة الصحة العالمية (المشار إليها بين قوسين):
- 1) قبل السريرية (دورة خفيفة) ،
- 2) تغيرات واسعة في الشرايين (معتدلة).
- 3) تغيرات في الأعضاء بسبب التغيرات في الشرايين وضعف تدفق الدم للأعضاء (شديدة) مرحلة ما قبل السريرية.
يتجلى سريريًا في ارتفاع ضغط الدم العابر (نوبات ارتفاع ضغط الدم). في المرحلة المبكرة من المرض ، يتم زيادة ثاني أكسيد الكربون ، ويظل TPVR ضمن النطاق الطبيعي لبعض الوقت ، ولكنه غير مناسب لهذا المستوى من ثاني أكسيد الكربون. ثم ، ربما كنتيجة لعمليات التنظيم الذاتي ، يبدأ OPVR في الزيادة ، ويعود ثاني أكسيد الكربون إلى المستويات الطبيعية.
في الشرايين والشرايين الصغيرة ، تم الكشف عن تضخم طبقة العضلات والبنى المرنة> زيادة تدريجية في سمك جدار الوعاء الدموي مع انخفاض في تجويفه ، والذي يتجلى سريريًا في OPSS. بعد مرور بعض الوقت ، على خلفية الكاتيكوليميا ، الهيماتوكريت ، نقص الأكسجة (عناصر جدار الشرايين والشرايين) ، تزداد نفاذية الأوعية الدموية ، مما يؤدي إلى تشريب البلازما لجدار الأوعية الدموية> انخفاض في مرونته وزيادة أكبر في ^ OPSS. التغييرات المورفولوجية في هذه المرحلة قابلة للعكس تمامًا ، ومع بدء العلاج الخافض للضغط في الوقت المناسب ، من الممكن منع تطور تلف العضو المستهدف.
في القلب ، بسبب الحمل اللاحق العابر ، يحدث تضخم تعويضي معتدل للبطين الأيسر ، حيث لا يزيد حجم القلب وسماكة جدار البطين الأيسر ^ وحجم تجويف البطين الأيسر تغيير أو قد ينقص بشكل طفيف - تضخم متحدة المركز (يميز مرحلة تعويض نشاط القلب).
مرحلة التغيرات المنتشرة في الشرايين. تجلى سريريا من خلال الزيادة المستمرة في ضغط الدم.
في الشرايين والشرايين الصغيرة من النوع العضلي ، تم الكشف عن داء الهيالين على نطاق واسع ، والذي تطور نتيجة لتشريب البلازما (نوع بسيط من هيالين الأوعية الدموية) ، أو تصلب الشرايين في الوسائط والبطانة الداخلية للشرايين استجابة لإطلاق البلازما و البروتينات. لوحظ التهاب الشرايين في الكلى والدماغ وشبكية العين والبنكرياس والأمعاء وكبسولة الغدة الكظرية. تبدو الأوعية المصفوفة بالميكروسكوب مثل الأنابيب الزجاجية ذات الجدران السميكة والتجويف الدقيق والاتساق الكثيف. مجهريًا ، تم الكشف عن كتل الحمضات المتجانسة في جدار الشرايين ، ويمكن أن تكون طبقات الجدار غير قابلة للتمييز عمليا.
في الشرايين المرنة والعضلية المرنة و أنواع العضلاتتطور: - التليف المرن - تضخم وانقسام الغشاء المرن الداخلي ، التصلب - تصلب الشرايين ، الذي له عدد من الميزات:
- أ) أكثر شيوعًا ، يلتقط الشرايين من النوع العضلي ،
- ب) تكون اللويحات الليفية دائرية بطبيعتها (وليست قطعية) ، مما يؤدي إلى تضيق أكبر في تجويف الوعاء الدموي.
في القلب ، تزداد درجة تضخم عضلة القلب ، ويمكن أن تصل كتلة القلب إلى 900-1000 جم ، وسماكة جدار البطين الأيسر 2-3 سم (cor bovinum). ومع ذلك ، بسبب النقص النسبي في إمدادات الدم (زيادة في حجم خلايا عضلة القلب ، وتضخم الشرايين والشرايين) وزيادة نقص الأكسجة ، يتطور التنكس الدهني لعضلة القلب والتوسع العضلي في التجاويف - تضخم عضلة القلب غريب الأطوار ، وتصلب القلب الصغير البؤري المنتشر ، تظهر علامات عدم المعاوضة القلبية.
3) مرحلة التغيرات في الأعضاء بسبب التغيرات في الشرايين وضعف تدفق الدم للأعضاء.
يمكن أن تتطور التغيرات الثانوية في الأعضاء في أمراض الشرايين غير المعقدة وتصلب الشرايين ببطء ، مما يؤدي إلى ضمور متني وتصلب انسجة.
مع إضافة تجلط الدم والتشنج والنخر الليفي أثناء الأزمة ، تحدث اضطرابات الدورة الدموية الحادة - النزيف والنوبات القلبية.
التغييرات في الدماغ:
نزيف بؤري صغير متعدد (hemorragia per diapedesin).
الورم الدموي - نزيف مع تدمير أنسجة المخ (نزيف الدم في الكائنات الدقيقة الدقيقة ، والتي تحدث في كثير من الأحيان على خلفية داء الهيالين مع نخر ليفي لجدار الشرايين المثقبة الصغيرة في الدماغ ، وخاصة النوى تحت القشرية والطبقة تحت القشرية). نتيجة للنزيف ، تتشكل أكياس صدئة في أنسجة المخ (اللون بسبب الهيموسيديرين).
في الكلى ، يتطور التصلب الكلوي الناتج عن تصلب الشرايين أو التجاعيد الأولية للكلى ، والتي تعتمد على التهاب الشرايين> الخراب مع التصلب والتشقق في الشعيرات الدموية الكبيبية> التصلب اللحمي بسبب نقص الأكسجة لفترات طويلة> ضمور ظهارة نبيبات الكلى.
الصورة العيانية: يتم تقليل حجم الكلى بشكل كبير (نوع من الضمور الموضعي بسبب نقص إمدادات الدم) ، والسطح دقيق الحبيبات ، وكثيف ، ويلاحظ ترقق في القشرة والنخاع على القطع ، وتكاثر الأنسجة الدهنية حولها الحوض. تتوافق مناطق الانكماش على سطح الكلى مع النيفرون الضامر ، وتتوافق البؤر المنتفخة مع النيفرون العامل في حالة تضخم تعويضي.
الصورة الميكروسكوبية: يتم زيادة سماكة جدران الشرايين بشكل كبير بسبب التراكم في البطانة والقشرة الوسطى من كتل الهيالين المتجانسة ضعيفة التأكسد (في بعض الحالات) مركبات اساسيهجدران الشرايين ، باستثناء البطانة ، ليست متباينة) ، يضيق التجويف (حتى الإزالة الكاملة). تنهار الكبيبات (تنهار) ، ويتم استبدال العديد منها النسيج الضامأو كتل من الهيالين (على شكل "رصائع" متجانسة مع أوكسفيلية قليلاً). الأنابيب ضامرة. يتم زيادة كمية النسيج الخلالي. النيفرون الباقي على قيد الحياة متضخم تعويضي.
يمكن أن يؤدي تصلب الكلى الناتج عن تصلب الشرايين إلى تطور الفشل الكلوي المزمن.
شكل خبيث من ارتفاع ضغط الدم:
نادرًا ما يُرى في الوقت الحاضر.
يحدث في المقام الأول أو يعقد ارتفاع ضغط الدم الحميد (أزمة ارتفاع ضغط الدم).
سريريا: مستوى Rdiast؟ 110-120 مم زئبق الفن ، الاضطرابات البصرية (بسبب وذمة القرص الثنائي العصب البصري) ، صداع شديد وبيلة دموية (أقل في كثير من الأحيان - انقطاع البول).
مستوى الرينين والأنجيوتنسين 2 في مصل الدم مرتفع ، فرط ألدستيرونية ثانوي مهم (مصحوب بنقص بوتاسيوم الدم).
يحدث في كثير من الأحيان عند الرجال في منتصف العمر (35-50 سنة ، ونادرًا ما يصل إلى 30 عامًا).
إنه يتطور بسرعة ، دون علاج يؤدي إلى تطور الفشل الكلوي المزمن (CRF) والموت في غضون 1-2 سنوات.
الصورة المورفولوجية:
مرحلة قصيرة من التشريب بالبلازما يتبعها نخر ليفي لجدار الشرايين> تلف بطاني> إضافة تجلط> تغيرات في الأعضاء: الحثل الإقفاري والنوبات القلبية والنزيف.
من جانب الشبكية: وذمة ثنائية في القرص البصري ، مصحوبة بانصباب بروتيني ونزيف في الشبكية
في الكلى: تصلب الكلية الخبيث (فارا) ، والذي يتميز بالنخر الليفي لجدران الشرايين والحلقات الشعرية في الكبيبات ، وذمة في النسيج الخلالي ، ونزيف> تفاعل خلوي وتصلب في الشرايين ، وكبيبات وسدى ، وتنكس بروتيني في الكبيبات. ظهارة نبيبات الكلى.
الصورة العيانية: يعتمد ظهور الكلى على مدة المرحلة الموجودة مسبقًا من ارتفاع ضغط الدم الحميد. في هذا الصدد ، يمكن أن يكون السطح أملسًا أو محببًا. يعتبر النزف النمري من الخصائص المميزة للغاية ، مما يعطي الكلى مظهرًا مرقشًا. يؤدي تطور العمليات النخرية والضمور بسرعة إلى تطوير كدو الموت.
في الدماغ: تنخر ليفية لجدران الشرايين مع تجلط الدم وتطور احتشاءات نقص تروية ونزفية ونزيف وذمة.
يمكن أن تحدث أزمة ارتفاع ضغط الدم - زيادة حادة في ضغط الدم مرتبطة بتشنج الشرايين - في أي مرحلة من مراحل ارتفاع ضغط الدم.
التغيرات المورفولوجية في أزمة ارتفاع ضغط الدم:
تشنج الشرايين: تموج وتدمير الغشاء القاعدي للبطانة وموقعها على شكل حاجز.
تشريب البلازما.
نخر ليفي في جدران الشرايين.
نزيف السكري.
الأشكال السريرية والمورفولوجية لـ AH:
اعتمادًا على غلبة عمليات الأوعية الدموية والضمور والنخر والنزيف والتصلب في عضو معين ، يتم تمييز الأشكال التالية:
شكل القلب - يشكل الجوهر مرض الشريان التاجيالقلب (مثل الشكل القلبي لتصلب الشرايين)
شكل الدماغ - يكمن وراء معظم أمراض الأوعية الدموية الدماغية (وكذلك تصلب الشرايين الدماغي)
يتميز الشكل الكلوي بكل من الحادة (تنخر شرياني - مظهر مورفولوجي لارتفاع ضغط الدم الخبيث) والتغيرات المزمنة (تصلب الكلية بتصلب الشرايين).
أرز. 1
قائمة الاختصارات لمحاضرة "ارتفاع ضغط الدم"
AG - ارتفاع ضغط الدم الشرياني.
BP - ضغط الدم.
BCC هو حجم الدورة الدموية.
ثاني أكسيد الكربون - النتاج القلبي.
OPSS - مقاومة الأوعية الدموية الطرفية الكلية.
SV - حجم الضربة.
معدل ضربات القلب - معدل ضربات القلب.
SNS - الجهاز العصبي الودي.
PSNS - الجهاز العصبي السمبتاوي.
RAAS - نظام الرينين - أنجيوتنسين - الألدوستيرون.
JUGA - الجهاز المجاور للكبيبات.
ACE هو إنزيم يحول الأنجيوتنسين.
GFR - معدل الترشيح الكبيبي.
منظمة الصحة العالمية هي منظمة الصحة العالمية.
CRF - الفشل الكلوي المزمن.








