Die Basis des Namens der Verbindung ist die Wortwurzel, die einen gesättigten Kohlenwasserstoff mit der gleichen Anzahl von Atomen wie die Hauptkette bezeichnet (z. B. met-, et-. pro p-, but-, pent-, hex -, etc.). Danach folgt ein den Sättigungsgrad charakterisierender Suffix, -an, wenn keine Mehrfachbindungen im Molekül vorhanden sind, -ene bei Vorhandensein von Doppelbindungen und -ni für Dreifachbindungen, z. B. Pentan, Penten. Sind mehrere Mehrfachbindungen im Molekül vorhanden, so ist die Anzahl solcher Bindungen im Suffix angegeben, zum Beispiel: -dien, -trien, und nach dem Suffix muss die Position der Mehrfachbindung in arabischen Ziffern angegeben werden (z B. Buten-1, Buten-2, Butadien-1,3) :
CH 3 -CH 2 -CH \u003d CH 2 CH 3 -CH \u003d CH-CH 3 CH 2 \u003d CH-CH \u003d CH 2
Buten-1 Buten-2 Butadien-1,3
Außerdem wird der Name der ältesten charakteristischen Gruppe im Molekül in das Suffix eingefügt und ihre Position mit einer Nummer angegeben. Andere Substituenten werden durch Präfixe bezeichnet. Allerdings sind sie nicht nach Dienstalter geordnet, sondern alphabetisch. Die Stellung des Substituenten wird durch eine Zahl vor dem Präfix angegeben, zB: 3-Methyl; 2-Chlor und dergleichen. Wenn im Molekül mehrere identische Substituenten vorhanden sind, wird deren Nummer vor dem Namen der entsprechenden Gruppe angegeben (z. B. Dimethyl-, Trichlor- usw.). Alle Zahlen in den Namen von Molekülen werden durch einen Bindestrich von den Wörtern und durch Kommas voneinander getrennt. Kohlenwasserstoffradikale haben ihre eigenen Namen.
Kohlenwasserstoffradikale begrenzen:
Methylethylpropylisopropyl
Butyl sek.-Butyl
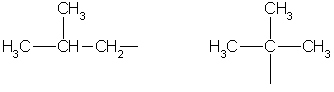
Isobutyl-tert.-butyl
Ungesättigte Kohlenwasserstoffreste:
CH 2 \u003d CH- HC - C- CH 2 \u003d CH-CH 2 -
Vinylethinylallyl
Aromatische Kohlenwasserstoffreste:

Phenylbenzol
Nehmen wir als Beispiel folgende Verbindung:

Die Wahl der Kette ist eindeutig, daher ist die Wortwurzel ein Pent, gefolgt vom Suffix -en, was auf das Vorhandensein einer Mehrfachbindung hinweist; die Nummerierungsreihenfolge gibt der höchsten Gruppe (-OH) die niedrigste Nummer; Der vollständige Name der Verbindung endet mit einem Suffix, das bezeichnet Seniorengruppe(in diesem Fall weist das Suffix –o l auf das Vorhandensein einer Hydroxylgruppe hin); die Stellung der Doppelbindung und der Hydroxylgruppe ist durch Zahlen angegeben.
Daher wird die angegebene Verbindung als Penten-4-ol-2 bezeichnet.
Die Trivialnomenklatur ist eine Sammlung nicht systematisch historisch gebildeter Namen organischer Verbindungen (zB: Aceton, Essigsäure, Formaldehyd etc.). Die wichtigsten Trivialnamen werden im Text bei Betrachtung der entsprechenden Verbindungsklassen eingeführt.
Die rationale Nomenklatur ermöglicht es Ihnen, den Namen einer Substanz basierend auf ihrer Struktur mit einer einfacheren Verbindung zu erstellen, die als Prototyp ausgewählt wurde. Die Art und Weise einer solchen Konstruktion wird durch die folgenden Beispiele veranschaulicht:
Trimethylmethan Acetylaceton Phenylessigsäure
Noch komplexer ist die Klassifizierung organischer Stoffe. Dies hat mehrere Gründe: die extreme Fülle organischer Verbindungen, die Komplexität und Vielfalt ihrer Struktur, die Geschichte der Erforschung von Kohlenstoffverbindungen.In der Tat bis zur Mitte des 19. Jahrhunderts. die organische chemie, umschrieben von F. Wöhler*, schien „ein dichter Wald voller erstaunlicher Dinge zu sein, ein grenzenloses Dickicht, aus dem man nicht herauskommt, in das man nicht hineinzudringen wagt“. Erst mit dem Erscheinen 1861 der Theorie chemische Struktur organische Verbindungen "dichter Wald"
organische Chemie begann sich in überflutet zu verwandeln Sonnenlicht ein regelmäßiger Park mit einem strengen Raster von Gassen und Wegen. Die Autoren dieser Theorie waren ein herausragendes internationales Trio von Chemiewissenschaftlern: unser Landsmann A. M. Butlerov **, der Deutsche F. A. Kekule und der Engländer A. Cooper.
Reis. 5. Friedrich Wöhler
(1800–1882)

Reis. 6. Alexander
Michailowitsch Butlerow
(1828–1886)
Die Essenz der von ihnen geschaffenen Theorie der chemischen Struktur kann in Form von drei Sätzen formuliert werden.
1. Atome in Molekülen sind entsprechend ihrer Wertigkeit in einer bestimmten Reihenfolge verbunden, und Kohlenstoff in organischen Verbindungen ist vierwertig.
2. Die Eigenschaften von Stoffen werden nicht nur durch die qualitative und quantitative Elementzusammensetzung bestimmt, sondern auch durch die Reihenfolge der Bindungen von Atomen in Molekülen, d.h. chemische Struktur.
3. Atome in Molekülen beeinflussen sich gegenseitig, was sich auf die Eigenschaften von Stoffen auswirkt.
* Deutscher Chemiker. Forschungstätigkeit auf dem Gebiet der anorganischen und organischen Chemie. Begründete die Existenz des Phänomens der Isomerie und führte zum ersten Mal die Synthese von organischem Material (Harnstoff) aus anorganischem Material durch. Erhielt einige Metalle (Aluminium, Beryllium usw.).
** Hervorragender russischer Chemiker, Autor der Theorie der Chemie
Struktur der organischen Materie. Bezogen aufStrukturkonzepte erklärten das Phänomen der Isomerie, sagten die Existenz von Isomeren einer Reihe von Stoffen voraus und synthetisierten sie erstmals. Er war der erste, der eine zuckerhaltige Substanz synthetisierte. Gründer der Schule für Russische Chemiekov, darunter V. V. Markovnikov, A. M. Zaitsev, E. E. Wagner, A. E. Favorsky und andere.
Heute scheint es unglaublich, dass Wissenschaftler bis zur Mitte des 19. Jahrhunderts, in der Zeit großer Entdeckungen in der Naturwissenschaft, eine schlechte Vorstellung vom inneren Aufbau der Materie hatten. Es war Butlerov, der den Begriff "chemische Struktur" einführte, was damit ein System chemischer Bindungen zwischen Atomen in einem Molekül bedeutet gegenseitiges Einverständnis im Weltraum. Dank dieses Verständnisses der Struktur des Moleküls wurde es möglich, das Phänomen der Isomerie zu erklären, die Existenz unbekannter Isomere vorherzusagen und die Eigenschaften von Substanzen mit ihrer chemischen Struktur zu korrelieren. Zur Veranschaulichung des Phänomens der Isomerie präsentieren wir die Formeln und Eigenschaften von zwei Substanzen – Ethylalkohol und Dimethylether, die die gleiche elementare Zusammensetzung von C2H6O, aber unterschiedliche chemische Strukturen haben (Tabelle 2).
Tabelle 2
Veranschaulichung der Abhängigkeit der Eigenschaften eines Stoffesaus seiner Struktur

Das in der organischen Chemie weit verbreitete Phänomen der Isomerie ist einer der Gründe für die Vielfalt organischer Substanzen. Ein weiterer Grund für die Vielfalt organischer Substanzen liegt in der einzigartigen Fähigkeit der Kohlenstoffatome, untereinander chemische Bindungen einzugehen, wodurch Kohlenstoffketten entstehen.
unterschiedliche Längen und Strukturen: unverzweigt, verzweigt, geschlossen. Beispielsweise können vier Kohlenstoffatome Ketten wie diese bilden:

Wenn wir berücksichtigen, dass es zwischen zwei Kohlenstoffatomen nicht nur einfache (einfache) C-C-Bindungen geben kann, sondern auch doppelte C=C- und dreifache C≡C-Bindungen, dann steigt die Anzahl der Varianten von Kohlenstoffketten und folglich verschiedene organische Substanzen nimmt deutlich zu.
Auch die Klassifikation organischer Substanzen basiert auf der Theorie der chemischen Struktur von Butlerov. Je nachdem welche Atome chemische Elemente Bestandteil des Moleküls sind alle organischen Großgruppen: Kohlenwasserstoffe, sauerstoffhaltige, stickstoffhaltige Verbindungen.
Kohlenwasserstoffe sind organische Verbindungen, die nur aus Kohlenstoff- und Wasserstoffatomen bestehen.
Je nach Struktur der Kohlenstoffkette, Vorhandensein oder Fehlen von Mehrfachbindungen werden alle Kohlenwasserstoffe in mehrere Klassen eingeteilt. Diese Klassen sind in Abbildung 2 dargestellt.
Wenn der Kohlenwasserstoff keine Mehrfachbindungen enthält und die Kette der Kohlenstoffatome nicht geschlossen ist, gehört er, wie Sie wissen, zur Klasse der gesättigten Kohlenwasserstoffe oder Alkane. Die Wurzel dieses Wortes ist arabischen Ursprungs, und das Suffix -en ist in den Namen aller Kohlenwasserstoffe dieser Klasse vorhanden.
Schema 2
Klassifizierung von Kohlenwasserstoffen

Das Vorhandensein einer Doppelbindung im Kohlenwasserstoffmolekül ermöglicht die Zuordnung zur Klasse der Alkene, und seine Verwandtschaft mit dieser Stoffgruppe wird betont
Suffix -en im Namen. Das einfachste Alken ist Ethylen mit der Formel CH2=CH2. In einem Molekül können zwei C=C-Doppelbindungen vorhanden sein, dann gehört die Substanz zur Klasse der Alkadiene.
Versuchen Sie, die Bedeutung der Suffixe -diene selbst zu erklären. Beispielsweise hat Butadien-1,3 die Strukturformel: CH2=CH–CH=CH2.
Kohlenwasserstoffe mit Kohlenstoff-Kohlenstoff-Dreifachbindungen im Molekül werden Alkine genannt. Das Suffix -in weist auf die Zugehörigkeit zu dieser Stoffklasse hin. Der Vorfahre der Klasse der Alkine ist Acetylen (Ethin), dessen Summenformel C2H2 ist und dessen Strukturformel HC≡CH ist. Aus Verbindungen mit geschlossener Kohlenstoffkette
Die wichtigsten Atome sind Arenen - eine besondere Klasse von Kohlenwasserstoffen, der Name des ersten Vertreters, von dem Sie wahrscheinlich gehört haben - das ist C6H6-Benzol, dessen Strukturformel auch jedem Kulturmenschen bekannt ist:

Wie Sie bereits verstanden haben, kann die Zusammensetzung organischer Substanzen neben Kohlenstoff und Wasserstoff auch Atome anderer Elemente enthalten, hauptsächlich Sauerstoff und Stickstoff. Meistens bilden die Atome dieser Elemente in verschiedenen Kombinationen Gruppen, die als funktional bezeichnet werden.
Eine funktionelle Gruppe ist eine Gruppe von Atomen, die die charakteristischsten bestimmt Chemische Eigenschaften Substanzen und ihre Zugehörigkeit zu einer bestimmten Klasse von Verbindungen.
Die Hauptklassen organischer Verbindungen mit funktionellen Gruppen sind in Schema 3 dargestellt.
Schema 3
Die Hauptklassen organischer Substanzen mit funktionellen Gruppen

Die funktionelle Gruppe -OH wird als Hydroxyl bezeichnet und bestimmt die Zugehörigkeit zu einer der wichtigsten Klassen organischer Substanzen - den Alkoholen.
Die Namen von Alkoholen werden mit dem Suffix -ol gebildet. Der bekannteste Vertreter ist beispielsweise der Alkohol Äthanol, oder Ethanol, C2H5OH.
Ein Sauerstoffatom kann durch eine chemische Doppelbindung an ein Kohlenstoffatom gebunden sein. Die Gruppe >C=O wird Carbonyl genannt. Die Carbonylgruppe ist Teil mehrerer
funktionelle Gruppen, einschließlich Aldehyd und Carboxyl. Organische Verbindungen, die diese funktionellen Gruppen enthalten, werden Aldehyde bzw. Carbonsäuren genannt. Die bekanntesten Vertreter der Aldehyde sind Formaldehyd HCO und Acetaldehyd CH3COH. AUS Essigsäure CH3COOH, dessen Lösung Tafelessig genannt wird, ist wohl jedem bekannt. Ein charakteristisches Strukturmerkmal stickstoffhaltiger organischer Verbindungen und vor allem Amine und Aminosäuren ist das Vorhandensein der Aminogruppe –NH2 in ihren Molekülen.
Auch die obige Einteilung organischer Stoffe ist sehr relativ. So wie ein Molekül (z. B. Alkadiene) zwei Mehrfachbindungen enthalten kann, kann ein Stoff zwei oder sogar mehr funktionelle Gruppen besitzen. So, strukturelle Einheiten Die Hauptträger des Lebens auf der Erde – Eiweißmoleküle – sind Aminosäuren. Die Moleküle dieser Substanzen enthalten notwendigerweise mindestens zwei funktionelle Gruppen - eine Carboxyl- und eine Aminogruppe. Die einfachste Aminosäure heißt Glycin und hat die Formel:

Wie amphotere Hydroxide vereinen Aminosäuren die Eigenschaften von Säuren (aufgrund der Carboxylgruppe) und Basen (aufgrund des Vorhandenseins einer Aminogruppe im Molekül).
Für die Organisation des Lebens auf der Erde sind die amphoteren Eigenschaften von Aminosäuren von besonderer Bedeutung - aufgrund des Zusammenspiels von Aminogruppen und Carboxylgruppen von Aminosäuren.
Lose sind zu Polymerketten von Proteinen verknüpft.
? 1. Was sind die wichtigsten Bestimmungen der Theorie der chemischen Struktur von A. M. Butlerov? Welche Rolle spielte diese Theorie bei der Entwicklung der organischen Chemie?
2. Welche Klassen von Kohlenwasserstoffen kennen Sie? Auf welcher Grundlage wurde diese Einstufung vorgenommen?
3. Wie nennt man die funktionelle Gruppe einer organischen Verbindung? Welche Funktionsgruppen können Sie nennen? Welche Klassen organischer Verbindungen enthalten diese funktionellen Gruppen? aufschreiben allgemeine Formeln Verbindungsklassen und Formeln ihrer Vertreter.
4. Geben Sie eine Definition von Isomerie an, schreiben Sie die Formeln möglicher Isomere für Verbindungen der Zusammensetzung C4H10O auf. Benennen Sie unter Verwendung verschiedener Informationsquellen jede von ihnen und erstellen Sie einen Bericht über eine der Verbindungen.
5. Ordnen Sie Stoffe der Formeln: C6H6, C2H6, C2H4, HCOOH, CH3OH, C6H12O6 den entsprechenden Klassen organischer Verbindungen zu. Benennen Sie unter Verwendung verschiedener Informationsquellen jede von ihnen und erstellen Sie einen Bericht über eine der Verbindungen.
6. Strukturformel von Glukose:  In welche Klasse organischer Verbindungen würden Sie diesen Stoff einordnen? Warum wird es eine Verbindung mit einer Doppelfunktion genannt?
In welche Klasse organischer Verbindungen würden Sie diesen Stoff einordnen? Warum wird es eine Verbindung mit einer Doppelfunktion genannt?
7. Vergleichen Sie organische und anorganische amphotere Verbindungen.
8. Warum werden Aminosäuren als Verbindungen mit Doppelfunktion bezeichnet? Welche Rolle spielt dieses Strukturmerkmal von Aminosäuren bei der Organisation des Lebens auf der Erde?
9. Bereiten Sie mit den Möglichkeiten des Internets eine Botschaft zum Thema „Aminosäuren sind die „Bausteine“ des Lebens“ vor.
10. Nennen Sie Beispiele für die Relativität der Einteilung organischer Verbindungen in bestimmte Klassen. Ziehen Sie Parallelen ähnlicher Relativitätstheorie für anorganische Verbindungen.
Die einfachste Einteilung ist in die alle bekannten Substanzen unterteilt sind anorganisch und organisch. Die organischen Substanzen sind Kohlenwasserstoffe und ihre Derivate. Alle anderen Stoffe sind anorganisch.

Nicht organische Materie unterteilt nach Zusammensetzung in einfach und komplex.

Einfache Substanzen bestehen aus Atomen eines chemischen Elements und werden in Metalle, Nichtmetalle, Edelgase unterteilt. Verbindungen bestehen aus Atomen verschiedener Elemente, die chemisch miteinander verbunden sind.
Komplexe anorganische Stoffe werden nach ihrer Zusammensetzung und ihren Eigenschaften in folgende Hauptklassen eingeteilt: Oxide, Basen, Säuren, amphotere Hydroxide, Salze.
- Oxide- Dies sind komplexe Substanzen, die aus zwei chemischen Elementen bestehen, von denen eines Sauerstoff mit einer Oxidationsstufe (-2) ist. Die allgemeine Formel von Oxiden ist: E m O n, wobei m die Anzahl der Atome des Elements E und n die Anzahl der Sauerstoffatome ist. Oxide wiederum werden in salzbildende und nicht salzbildende eingeteilt. Salzbildende Substanzen werden in basische, amphotere, saure Substanzen unterteilt, die Basen, amphoteren Hydroxiden bzw. Säuren entsprechen.
- Basische Oxide sind Metalloxide in den Oxidationsstufen +1 und +2. Diese beinhalten:
- Metalloxide der Hauptuntergruppe der ersten Gruppe ( Alkali Metalle) Li-Fr
- Metalloxide der Hauptuntergruppe der zweiten Gruppe ( Mg und Erdalkalimetalle) Mg-Ra
- Übergangsmetalloxide in niedrigeren Oxidationsstufen
- Säureoxide- bilden Nichtmetalle mit S.O. mehr als +2 und Metalle mit S.O. von +5 bis +7 (SO 2, SeO 2, P 2 O 5, As 2 O 3, CO 2, SiO 2, CrO 3 und Mn 2 O 7). Ausnahme: für NO-Oxide 2 und ClO 2 Es gibt keine entsprechenden Säurehydroxide, aber sie gelten als sauer.
- Amphotere Oxide-gebildet durch amphotere Metalle mit S.O. +2, +3, +4 (BeO, Cr 2 O 3 , ZnO, Al 2 O 3 , GeO 2 , SnO 2 und PbO).
- Nicht salzbildende Oxide- Oxide von Nichtmetallen mit С.О.+1, +2 (СО, NO, N 2 O, SiO).
- Stiftungen- dies sind komplexe Substanzen, die aus Metallatomen und einer oder mehreren Hydroxogruppen (-OH) bestehen. Allgemeine Basenformel: M (OH) y, wobei y die Anzahl der Hydroxogruppen ist, gleichen Grades Oxidation von Metall M (normalerweise +1 und +2). Basen werden in lösliche (alkalische) und unlösliche unterteilt.
- Säuren- (Säurehydroxide) sind komplexe Substanzen, die aus Wasserstoffatomen, die durch Metallatome ersetzt werden können, und Säureresten bestehen. Die allgemeine Formel von Säuren: H x Ac, wobei Ac ein Säurerest ist (aus dem Englischen "Säure" - Säure), x ist die Anzahl der Wasserstoffatome, die der Ladung des Ions des Säurerests entspricht.
- Amphotere Hydroxide sind komplexe Substanzen, die sowohl die Eigenschaften von Säuren als auch die Eigenschaften von Basen aufweisen. Daher können die Formeln amphoterer Hydroxide sowohl in Form von Säuren als auch in Form von Basen geschrieben werden.
- Salz- Dies sind komplexe Substanzen, die aus Metallkationen und Anionen von Säureresten bestehen. Diese Definition gilt für mittlere Salze.
- Mittlere Salze- dies sind die Produkte des vollständigen Ersatzes von Wasserstoffatomen im Säuremolekül durch Metallatome oder des vollständigen Ersatzes von Hydroxogruppen im Basismolekül durch Säurereste.
- Saure Salze- Wasserstoffatome in der Säure werden teilweise durch Metallatome ersetzt. Sie werden durch Neutralisation einer Base mit einem Überschuss einer Säure erhalten. Richtig benennen saures Salz, je nach Anzahl der Wasserstoffatome, aus denen das Säuresalz besteht, muss dem Namen des normalen Salzes das Präfix Hydro- oder Dihydro- hinzugefügt werden, beispielsweise ist KHCO 3 Kaliumbicarbonat, KH 2 PO 4 ist Kaliumdihydroorthophosphat . Daran muss man sich erinnern saure Salze kann nur zwei oder mehr basische Säuren bilden.
- Basische Salze- Hydroxogruppen der Base (OH -) sind teilweise durch saure Reste ersetzt. Benennen basisches Salz, je nach Anzahl der OH-Gruppen, aus denen das Salz besteht, muss dem Namen des Normalsalzes die Vorsilbe Hydroxo- oder Dihydroxo- vorangestellt werden (CuOH) 2 CO 3 ist beispielsweise Kupfer(II)-Hydroxocarbonat Es ist zu beachten, dass basische Salze nur Basen bilden können, die zwei oder mehr Hydroxogruppen enthalten.
- Doppelsalze- In ihrer Zusammensetzung gibt es zwei verschiedene Kationen, sie werden durch Kristallisation aus einer gemischten Lösung von Salzen mit verschiedenen Kationen, aber denselben Anionen erhalten. Zum Beispiel KAl(SO 4) 2, KNaSO 4.
- gemischte Salze- in ihrer Zusammensetzung gibt es zwei verschiedene Anionen. Zum Beispiel Ca(OCl)Cl.
- Hydratsalze (Kristallhydrate) - sie enthalten Kristallwassermoleküle. Beispiel: Na 2 SO 4 · 10H 2 O.

Einstufung organischer Stoffe
Verbindungen, die nur Wasserstoff- und Kohlenstoffatome enthalten, werden genannt Kohlenwasserstoffe. Bevor Sie mit diesem Abschnitt beginnen, denken Sie daran, dass Chemiker zur Vereinfachung der Aufzeichnung Kohlenstoffe und Wasserstoffe nicht in Ketten malen, aber vergessen Sie nicht, dass Kohlenstoff vier Bindungen bildet, und wenn in der Abbildung Kohlenstoff durch zwei Bindungen gebunden ist, dann ist es durch zwei Bindungen gebunden mehr Bindungen zu Wasserstoffen, obwohl die letzten und nicht spezifiziert:

Abhängig von der Struktur der Kohlenstoffkette werden organische Verbindungen in Verbindungen mit offener Kette unterteilt - azyklisch(aliphatisch) und zyklisch- mit einer geschlossenen Atomkette.
Zyklisch werden in zwei Gruppen eingeteilt: carbozyklisch Verbindungen u heterozyklisch.
Carbocyclische Verbindungen wiederum zwei Reihen von Verbindungen: alicyclisch und aromatisch.
aromatische Verbindungen Die Struktur von Molekülen basiert auf flachen kohlenstoffhaltigen Kreisläufen mit einem speziellen geschlossenen System von π-Elektronen. Bildung eines gemeinsamen π-Systems (eine einzelne π-Elektronenwolke).

Sowohl acyclische (aliphatische) als auch cyclische Kohlenwasserstoffe können Mehrfach- (Doppel- oder Dreifach-) Bindungen enthalten. Diese Kohlenwasserstoffe werden genannt unbegrenzt(ungesättigt), im Gegensatz zu marginal(gesättigt) mit nur Einfachbindungen.
Pi-Bindung (π-Bindung) - eine kovalente Bindung, die durch die Überlappung von p-Atomorbitalen gebildet wird. Im Gegensatz zur Sigma-Bindung, die auftritt, wenn sich s-Atomorbitale entlang der Atombindungslinie überlappen, treten Pi-Bindungen auf, wenn p-Atomorbitale auf beiden Seiten der Atombindungslinie überlappen.
Bei der Bildung eines aromatischen Systems, beispielsweise Benzol C6H6, befindet sich jedes der sechs Kohlenstoffatome im Zustand der sp2-Hybridisierung und bildet drei Sigma-Bindungen mit Bindungswinkeln von 120°. Das vierte p-Elektron jedes Kohlenstoffatoms ist senkrecht zur Ebene des Benzolrings orientiert. Im Allgemeinen entsteht eine Einfachbindung, die sich über alle Kohlenstoffatome des Benzolrings erstreckt. Zwei Bereiche von Pi-Bindungen mit hoher Elektronendichte werden auf beiden Seiten der Ebene von Sigma-Bindungen gebildet. Mit einer solchen Bindung werden alle Kohlenstoffatome im Benzolmolekül äquivalent und daher ist ein solches System stabiler als ein System mit drei lokalisierten Doppelbindungen.

Limitierte aliphatische Kohlenwasserstoffe werden als Alkane bezeichnet, sie haben die allgemeine Formel C n H 2n+2, wobei n die Anzahl der Kohlenstoffatome ist. Ihr alter Name wird heute oft verwendet - Paraffine:
Ungesättigte aliphatische Kohlenwasserstoffe mit einer Dreifachbindung werden Alkine genannt. Ihre allgemeine Formel C n H 2n - 2
Limit alicyclische Kohlenwasserstoffe - Cycloalkane, ihre allgemeine Formel ist C n H 2n:

Wir haben die Klassifizierung von Kohlenwasserstoffen betrachtet. Aber wenn in diesen Molekülen ein oder mehr Wasserstoffatome werden durch andere Atome oder Atomgruppen (Halogene, Hydroxylgruppen, Aminogruppen usw.) ersetzt, es entstehen Derivate von Kohlenwasserstoffen: Halogenderivate, sauerstoffhaltige, stickstoffhaltige und andere organische Verbindungen.

Die Atome oder Atomgruppen, die die charakteristischsten Eigenschaften einer bestimmten Stoffklasse bestimmen, werden als funktionelle Gruppen bezeichnet.
Kohlenwasserstoffe in ihren Derivaten mit gleicher funktioneller Gruppe bilden homologe Reihen.
Eine homologe Reihe ist eine Reihe von Verbindungen, die zur gleichen Klasse gehören (Homologe), die sich in der Zusammensetzung durch eine ganze Zahl von -CH 2 -Gruppen voneinander unterscheiden (homologer Unterschied), eine ähnliche Struktur und daher ähnliche chemische Eigenschaften aufweisen.
Die Ähnlichkeit der chemischen Eigenschaften von Homologen vereinfacht die Untersuchung organischer Verbindungen erheblich.
Substituierte Kohlenwasserstoffe
- Halogenderivate von Kohlenwasserstoffen können als Produkte der Substitution in Kohlenwasserstoffen von einem oder mehreren Wasserstoffatomen durch Halogenatome angesehen werden. Dementsprechend können gesättigte und ungesättigte Mono-, Li-, Tri- (in der Regel Poly-) Halogenderivate existieren, Ether und Ester.
- Alkohole- Derivate von Kohlenwasserstoffen, bei denen ein oder mehrere Wasserstoffatome durch Hydroxylgruppen ersetzt sind. Alkohole werden als einwertig bezeichnet, wenn sie eine Hydroxylgruppe aufweisen, und als Limit, wenn sie Derivate von Alkanen sind. Die allgemeine Formel für Limit einwertige Alkohole: R-OH.
- Phenole- Derivate aromatischer Kohlenwasserstoffe (Benzolreihe), bei denen ein oder mehrere Wasserstoffatome im Benzolring durch Hydroxylgruppen ersetzt sind.
- Aldehyde und Ketone- Derivate von Kohlenwasserstoffen, die eine Carbonylgruppe von Atomen (Carbonyl) enthalten. In Aldehydmolekülen geht eine Carbonylbindung zur Verbindung mit einem Wasserstoffatom, die andere - mit einem Kohlenwasserstoffrest. Bei Ketonen ist die Carbonylgruppe an gebunden zwei (im Allgemeinen verschiedene) Radikale.
- Äther sind organische Substanzen, die zwei durch ein Sauerstoffatom verbundene Kohlenwasserstoffreste enthalten: R = O-R oder R-O-R 2 .Die Reste können gleich oder verschieden sein. Die Zusammensetzung von Ethern wird durch die Formel C n H 2n +2O ausgedrückt.
- Ester- Verbindungen, die durch Substitution eines Wasserstoffatoms der Carboxylgruppe in gebildet werden Carbonsäuren zu einem Kohlenwasserstoffrest.
- Nitroverbindungen- Derivate von Kohlenwasserstoffen, in denen ein oder mehrere Wasserstoffatome durch eine Nitrogruppe -NO 2 ersetzt sind.
- Amine- Verbindungen, die als Derivate von Ammoniak gelten, in denen Wasserstoffatome durch Kohlenwasserstoffreste ersetzt sind Je nach Art des Rests können Amine aliphatisch sein. Je nach Anzahl der durch Reste ersetzten Wasserstoffatome unterscheidet man primäre, sekundäre und tertiäre Amine. Im Einzelfall können sowohl sekundäre als auch tertiäre Amine die gleichen Reste aufweisen. Primäre Amine können auch als Derivate von Kohlenwasserstoffen (Alkanen) angesehen werden, bei denen ein Wasserstoffatom durch eine Aminogruppe ersetzt ist. Aminosäuren enthalten zwei funktionelle Gruppen, die mit einem Kohlenwasserstoffrest verbunden sind – eine Aminogruppe -NH 2 und eine Carboxylgruppe -COOH.
Andere wichtige organische Verbindungen sind bekannt, die mehrere unterschiedliche oder identische funktionelle Gruppen aufweisen, lange lineare Ketten, die mit Benzolringen assoziiert sind. In solchen Fällen ist eine strenge Definition, ob ein Stoff zu einer bestimmten Klasse gehört, nicht möglich. Diese Verbindungen werden oft in bestimmte Stoffgruppen isoliert: Kohlenhydrate, Proteine, Nukleinsäuren, Antibiotika, Alkaloide usw. Derzeit gibt es auch viele Verbindungen, die sowohl organischen als auch anorganischen zugeschrieben werden können. Sie werden elementorganische Verbindungen genannt. Einige von ihnen können als Derivate von Kohlenwasserstoffen betrachtet werden.
Nomenklatur
Zur Benennung organischer Verbindungen werden zwei Nomenklaturen verwendet - rational und systematisch (IUPAC) und Trivialnamen.

Zusammenstellung der Namen nach der IUPAC-Nomenklatur:
1) Die Basis des Namens der Verbindung ist die Wortwurzel, die einen gesättigten Kohlenwasserstoff mit der gleichen Anzahl von Atomen wie die Hauptkette bezeichnet.
2) Der Wurzel wird ein Suffix hinzugefügt, das den Sättigungsgrad charakterisiert:
An (limitierend, keine Mehrfachbindungen);
Yong (in Gegenwart einer Doppelbindung);
Ying (in Gegenwart einer Dreifachbindung).

Sind mehrere Mehrfachbindungen vorhanden, so ist im Suffix die Anzahl solcher Bindungen (-Dien, -Trien etc.) anzugeben und nach dem Suffix ist die Position der Mehrfachbindung in Zahlen anzugeben, z. B.:
CH 3 -CH 2 -CH \u003d CH 2 CH 3 -CH \u003d CH -CH 3
Buten-1 Buten-2
CH 2 \u003d CH - CH \u003d CH 2
Gruppen wie Nitro-, Halogene, Kohlenwasserstoffreste, die nicht in der Hauptkette enthalten sind, sind dem Präfix vorangestellt. Sie sind in alphabetischer Reihenfolge aufgeführt. Die Position des Substituenten wird durch eine Zahl vor dem Präfix angegeben.
Die Titelreihenfolge ist wie folgt:
1. Finden Sie die längste Kette von C-Atomen.
2. Nummerieren Sie fortlaufend die Kohlenstoffatome der Hauptkette, beginnend mit dem Ende, das der Verzweigung am nächsten liegt.
3. Der Name eines Alkans setzt sich zusammen aus den Namen der Seitenreste, aufgelistet in alphabetischer Reihenfolge, die die Position in der Hauptkette angeben, und dem Namen der Hauptkette.
 Reihenfolge der Benennung
Reihenfolge der Benennung Die chemische Sprache, die als einer der spezifischsten Teile die chemische Symbolik (einschließlich und chemische Formeln), ist ein wichtiges aktives Mittel zum Erlernen der Chemie und bedarf daher einer klaren und bewussten Anwendung.
Chemische Formeln- dies sind bedingte Abbildungen der Zusammensetzung und Struktur chemisch einzelner Stoffe durch chemische Symbole, Indizes und andere Zeichen. Bei der Untersuchung der Zusammensetzung, chemischen, elektronischen und räumlichen Struktur von Substanzen, ihrer physikalischen und chemischen Eigenschaften, Isomerie und anderer Phänomene werden chemische Formeln verschiedener Art verwendet.
Besonders viele Arten von Formeln (die einfachsten, molekularen, strukturellen, Projektions-, Konformationsformeln usw.) werden bei der Untersuchung von Substanzen mit molekularer Struktur verwendet - die meisten organischen Substanzen und ein relativ kleiner Teil anorganischer Substanzen unter normalen Bedingungen. Deutlich weniger Arten von Formeln (die einfachsten) werden beim Studium nichtmolekularer Verbindungen verwendet, deren Struktur deutlicher durch Kugel-Stab-Modelle und Diagramme von Kristallstrukturen oder ihren Elementarzellen wiedergegeben wird.

Erstellen von vollständigen und kurzen Strukturformeln von Kohlenwasserstoffen
Beispiel:
Schreiben Sie eine vollständige und prägnant Strukturformeln Propan C 3 H 8.
Lösung:
1. Schreiben Sie 3 Kohlenstoffatome in eine Linie und verbinden Sie sie mit Bindungen:
S–S–S
2. Fügen Sie Bindestriche (Bindungen) hinzu, sodass sich von jedem Kohlenstoffatom 4 Bindungen erstrecken:


4. Schreiben Sie eine kurze Strukturformel auf:
CH3-CH2-CH3
Löslichkeitstabelle
Organische Verbindungen werden nach zwei Hauptstrukturmerkmalen klassifiziert:
Die Struktur der Kohlenstoffkette (Kohlenstoffskelett);
Das Vorhandensein und die Struktur funktioneller Gruppen.
Kohlenstoffgerüst (Kohlenstoffkette) - eine Abfolge chemisch gebundener Kohlenstoffatome.
Funktionelle Gruppe - ein Atom oder eine Gruppe von Atomen, die bestimmt, ob eine Verbindung zu einer bestimmten Klasse gehört und für ihre chemischen Eigenschaften verantwortlich ist.
Klassifizierung von Verbindungen nach der Struktur der Kohlenstoffkette
Abhängig von der Struktur der Kohlenstoffkette werden organische Verbindungen in azyklisch und zyklisch unterteilt.
Acyclische Verbindungen - Verbindungen mit offen(offene) Kohlenstoffkette. Diese Verbindungen werden auch genannt aliphatisch.
Unter acyclischen Verbindungen werden limitierende (gesättigte) Verbindungen unterschieden, die nur einzelne im Gerüst enthalten C-C-Verbindungen und unbegrenzt(ungesättigt), einschließlich Mehrfachbindungen C = C und C C.
Acyclische Verbindungen
Grenze:

Unbegrenzt:

Acyclische Verbindungen werden auch in Verbindungen mit unverzweigten und unterteilt verzweigte Kette. Dabei wird die Anzahl der Bindungen eines Kohlenstoffatoms mit anderen Kohlenstoffatomen berücksichtigt.
Die Kette, die tertiäre oder quartäre Kohlenstoffatome enthält, ist verzweigt (häufig durch das Präfix „iso“ im Namen gekennzeichnet).
Zum Beispiel:

Kohlenstoffatome:
Primär;
Sekundär;
Tertiär.
Cyclische Verbindungen sind Verbindungen mit einer geschlossenen Kohlenstoffkette.
Abhängig von der Art der Atome, aus denen der Zyklus besteht, werden carbocyclische und heterocyclische Verbindungen unterschieden.
Carbocyclische Verbindungen enthalten nur Kohlenstoffatome im Zyklus. Sie werden in zwei Gruppen eingeteilt, die sich in ihren chemischen Eigenschaften deutlich unterscheiden: aliphatische cyclische – kurz alicyclische – und aromatische Verbindungen.
Carbocyclische Verbindungen
Alyzyklisch:

Aromatisch:

Heterozyklische Verbindungen enthalten im Ring neben Kohlenstoffatomen ein oder mehrere Atome anderer Elemente - Heteroatome(aus dem Griechischen. Heteros- andere, andere) - Sauerstoff, Stickstoff, Schwefel usw.
Heterocyclische Verbindungen

Klassifizierung von Verbindungen nach funktionellen Gruppen
Verbindungen, die nur Kohlenstoff und Wasserstoff enthalten, werden als Kohlenwasserstoffe bezeichnet.
Andere, zahlreichere organische Verbindungen können als Derivate von Kohlenwasserstoffen angesehen werden, die entstehen, wenn funktionelle Gruppen, die andere Elemente enthalten, in Kohlenwasserstoffe eingeführt werden.
Abhängig von der Art der funktionellen Gruppen werden organische Verbindungen in Klassen eingeteilt. Einige der charakteristischsten funktionellen Gruppen und ihre entsprechenden Verbindungsklassen sind in der Tabelle aufgeführt:
Klassen organischer Verbindungen

Hinweis: Funktionelle Gruppen werden manchmal als Doppel- und Dreifachbindungen bezeichnet.
Moleküle organischer Verbindungen können zwei oder mehr gleiche oder verschiedene funktionelle Gruppen enthalten.
Zum Beispiel: HO-CH 2 -CH 2 -OH (Ethylenglycol); NH 2 -CH 2 - COOH (Aminosäure Glycin).
Alle Klassen organischer Verbindungen sind miteinander verbunden. Der Übergang von einer Verbindungsklasse zur anderen erfolgt hauptsächlich aufgrund der Umwandlung funktioneller Gruppen ohne Veränderung des Kohlenstoffgerüsts. Verbindungen jeder Klasse bilden eine homologe Reihe.
In der Vergangenheit haben Wissenschaftler alle Substanzen in der Natur in bedingt unbelebte und lebende eingeteilt, darunter auch das Tier- und Pflanzenreich. Stoffe der ersten Gruppe werden Mineral genannt. Und diejenigen, die in die zweite eintraten, wurden organische Substanzen genannt.
Was ist damit gemeint? Die Klasse der organischen Substanzen ist die umfangreichste von allen Chemische Komponenten modernen Wissenschaftlern bekannt. Die Frage, welche Stoffe organisch sind, kann wie folgt beantwortet werden – das sind chemische Verbindungen, die Kohlenstoff enthalten.
Bitte beachten Sie, dass nicht alle kohlenstoffhaltigen Verbindungen organisch sind. Zum Beispiel Corbide und Carbonate, Kohlensäure und Cyanide, Kohlenoxide gehören nicht dazu.
Warum gibt es so viele organische Substanzen?
Die Antwort auf diese Frage liegt in den Eigenschaften von Kohlenstoff. Dieses Element ist insofern merkwürdig, als es in der Lage ist, Ketten aus seinen Atomen zu bilden. Und gleichzeitig ist die Kohlenstoffbindung sehr stabil.
Außerdem weist es in organischen Verbindungen eine hohe Wertigkeit (IV) auf, d.h. die Fähigkeit, mit anderen Stoffen chemische Bindungen einzugehen. Und nicht nur einfach, sondern auch doppelt und sogar dreifach (ansonsten - Vielfache). Mit zunehmender Bindungsmultiplizität wird die Atomkette kürzer und die Bindungsstabilität nimmt zu.
Und Kohlenstoff ist mit der Fähigkeit ausgestattet, lineare, flache und dreidimensionale Strukturen zu bilden.
Deshalb sind organische Stoffe in der Natur so vielfältig. Sie können es ganz einfach selbst überprüfen: Stellen Sie sich vor einen Spiegel und betrachten Sie Ihr Spiegelbild genau. Jeder von uns ist ein wandelndes Lehrbuch der organischen Chemie. Denken Sie darüber nach: Mindestens 30 % der Masse jeder Ihrer Zellen sind organische Verbindungen. Die Proteine, die Ihren Körper aufgebaut haben. Kohlenhydrate, die als "Treibstoff" und Energiequelle dienen. Fette, die Energiereserven speichern. Hormone, die die Organfunktion und sogar Ihr Verhalten steuern. Enzyme, die starten chemische Reaktionen in dir. Und selbst der „Quellcode“, die DNA-Stränge, sind alle auf Kohlenstoff basierende organische Verbindungen.
Zusammensetzung organischer Substanzen
Wie wir ganz am Anfang gesagt haben, ist der Hauptbaustoff für organisches Material Kohlenstoff. Und praktisch alle Elemente können in Verbindung mit Kohlenstoff organische Verbindungen bilden.
In der Natur sind am häufigsten in der Zusammensetzung organischer Substanzen Wasserstoff, Sauerstoff, Stickstoff, Schwefel und Phosphor.
Die Struktur organischer Substanzen
Die Vielfalt organischer Substanzen auf dem Planeten und die Vielfalt ihrer Struktur lassen sich erklären Charakteristische Eigenschaften Kohlenstoffatome.
Sie erinnern sich, dass Kohlenstoffatome in der Lage sind, sehr starke Bindungen miteinander einzugehen und sich in Ketten zu verbinden. Das Ergebnis sind stabile Moleküle. Die Art und Weise, wie Kohlenstoffatome in einer Kette verbunden sind (in einem Zickzackmuster angeordnet), ist eines der Schlüsselmerkmale seiner Struktur. Kohlenstoff kann sich sowohl zu offenen Ketten als auch zu geschlossenen (cyclischen) Ketten verbinden.
Wichtig ist auch die Struktur Chemikalien wirkt sich direkt auf ihre chemischen Eigenschaften aus. Eine wesentliche Rolle spielt auch, wie sich Atome und Atomgruppen in einem Molekül gegenseitig beeinflussen.
Aufgrund der Besonderheiten der Struktur geht die Anzahl der Kohlenstoffverbindungen des gleichen Typs in die Zehner- und Hundertergruppe. Zum Beispiel können wir Wasserstoffverbindungen von Kohlenstoff betrachten: Methan, Ethan, Propan, Butan usw.
Zum Beispiel Methan - CH 4. Diese Kombination aus Wasserstoff und Kohlenstoff normale Bedingungen befindet sich in einem gasförmigen Aggregatzustand. Wenn Sauerstoff in der Zusammensetzung erscheint, wird eine Flüssigkeit gebildet - Methylalkohol CH 3 OH.
Nicht nur Stoffe unterschiedlicher qualitativer Zusammensetzung (wie im obigen Beispiel) weisen unterschiedliche Eigenschaften auf, sondern auch Stoffe gleicher qualitativer Zusammensetzung sind dazu in der Lage. Ein Beispiel ist die unterschiedliche Fähigkeit von Methan CH 4 und Ethylen C 2 H 4 , mit Brom und Chlor zu reagieren. Methan ist zu solchen Reaktionen nur in der Lage, wenn es erhitzt oder unter ultraviolettem Licht steht. Und Ethylen reagiert auch ohne Beleuchtung und Heizung.
Ziehen Sie diese Option in Betracht: Die qualitative Zusammensetzung chemischer Verbindungen ist gleich, die quantitative ist unterschiedlich. Dann sind die chemischen Eigenschaften der Verbindungen unterschiedlich. Wie im Fall von Acetylen C 2 H 2 und Benzol C 6 H 6.
Nicht die letzte Rolle in dieser Vielfalt spielen solche Eigenschaften organischer Substanzen, die an ihre Struktur "gebunden" sind, wie Isomerie und Homologie.
Stellen Sie sich vor, Sie haben zwei scheinbar identische Substanzen – dieselbe Zusammensetzung und dieselbe Summenformel, um sie zu beschreiben. Aber die Struktur dieser Substanzen ist grundlegend verschieden, woraus der Unterschied in chemischen und folgt physikalische Eigenschaften. Z.B, Molekularformel Mit 4 H 10 kannst du zwei schreiben verschiedene Substanzen: Butan und Isobutan.

Es handelt sich dabei um Isomere- Verbindungen, die die gleiche Zusammensetzung und das gleiche Molekulargewicht haben. Aber die Atome in ihren Molekülen befinden sich in einer anderen Reihenfolge (verzweigte und unverzweigte Struktur).
Hinsichtlich Homologie ist ein Merkmal einer solchen Kohlenstoffkette, in der jeder nächstes Mitglied kann durch Anfügen einer CH 2 -Gruppe an die vorherige erhalten werden. Jede homologe Reihe kann durch eine allgemeine Formel ausgedrückt werden. Und wenn man die Formel kennt, ist es einfach, die Zusammensetzung eines der Mitglieder der Reihe zu bestimmen. Beispielsweise werden Methan-Homologe durch die Formel C n H 2n+2 beschrieben.
Durch die Zugabe des „homologen Unterschieds“ CH 2 wird die Bindung zwischen den Atomen der Substanz verstärkt. Nehmen wir die homologe Reihe von Methan: Die ersten vier Mitglieder sind Gase (Methan, Ethan, Propan, Butan), die nächsten sechs sind Flüssigkeiten (Pentan, Hexan, Heptan, Oktan, Nonan, Decan) und dann Substanzen im festen Zustand der Aggregation folgen (Pentadecan, Eicosan usw.). Und je stärker die Bindung zwischen Kohlenstoffatomen ist, desto höher sind das Molekulargewicht, die Siede- und Schmelzpunkte der Substanzen.
Welche Klassen organischer Substanzen gibt es?
Zu den organischen Stoffen biologischen Ursprungs gehören:
- Proteine;
- Kohlenhydrate;
- Nukleinsäuren;
- Lipide.
Die ersten drei Punkte können auch als biologische Polymere bezeichnet werden.
Mehr detaillierte Klassifizierung Organische Chemikalien umfassen Stoffe, die nicht nur biologischen Ursprungs sind.
Die Kohlenwasserstoffe sind:
- acyclische Verbindungen:
- gesättigte Kohlenwasserstoffe (Alkane);
- ungesättigte Kohlenwasserstoffe:
- Alkene;
- Alkine;
- Alkadiene.
- zyklische Verbindungen:
- carbocyclische Verbindungen:
- alizyklisch;
- aromatisch.
- heterocyclische Verbindungen.
- carbocyclische Verbindungen:
Es gibt auch andere Klassen organischer Verbindungen, in denen sich Kohlenstoff mit anderen Substanzen als Wasserstoff verbindet:
- Alkohole und Phenole;
- Aldehyde und Ketone;
- Carbonsäuren;
- Ester;
- Lipide;
- Kohlenhydrate:
- Monosaccharide;
- Oligosaccharide;
- Polysaccharide.
- Mucopolysaccharide.
- Amine;
- Aminosäuren;
- Proteine;
- Nukleinsäuren.
Formeln organischer Substanzen nach Klassen

Beispiele für organische Substanzen
Wie Sie sich erinnern, in menschlicher Körper verschiedene Sorten organische substanzen sind die basis der grundlagen. Dies sind unsere Gewebe und Flüssigkeiten, Hormone und Pigmente, Enzyme und ATP und vieles mehr.
Im Körper von Menschen und Tieren werden Proteine und Fette priorisiert (die Hälfte des Trockengewichts einer tierischen Zelle besteht aus Protein). In Pflanzen (ca. 80 % der Trockenmasse der Zelle) - für Kohlenhydrate vor allem komplexe - Polysaccharide. Unter anderem für Zellulose (ohne die es kein Papier gäbe), Stärke.
Lassen Sie uns über einige von ihnen ausführlicher sprechen.
Zum Beispiel ca Kohlenhydrate. Wenn es möglich wäre, die Massen aller organischen Substanzen auf dem Planeten zu nehmen und zu messen, wären es die Kohlenhydrate, die diesen Wettbewerb gewinnen würden.
Sie dienen als Energiequelle im Körper, sind Baumaterial für Zellen, sowie die Stoffversorgung übernehmen. Pflanzen verwenden zu diesem Zweck Stärke und Glykogen für Tiere.
Zudem sind Kohlenhydrate sehr vielfältig. Zum Beispiel, einfache Kohlenhydrate. Die in der Natur am häufigsten vorkommenden Monosaccharide sind Pentosen (einschließlich Desoxyribose, die Teil der DNA ist) und Hexosen (Glucose, die Ihnen gut bekannt ist).
Wie Ziegel werden auf einer Großbaustelle der Natur Polysaccharide aus Abertausenden von Monosacchariden aufgebaut. Ohne sie, genauer gesagt ohne Zellulose, Stärke, gäbe es keine Pflanzen. Ja, und Tiere ohne Glykogen, Laktose und Chitin hätten es schwer.
Schauen wir genau hin Eichhörnchen. Die Natur ist die größte Meisterin der Mosaike und Puzzles: Aus nur 20 Aminosäuren werden im menschlichen Körper 5 Millionen Arten von Proteinen gebildet. Auch auf Proteinen steckt viel Vitalität. wichtige Funktionen. Zum Beispiel Aufbau, Regulierung von Vorgängen im Körper, Blutgerinnung (dafür gibt es eigene Proteine), Bewegung, Transport bestimmter Stoffe im Körper, sie sind auch Energielieferant, in Form von Enzymen wirken sie als ein Katalysator für Reaktionen, bieten Schutz. Beim Schutz des Körpers vor Negativ äußere Einflüsse Antikörper spielen eine wichtige Rolle. Und wenn drin Feinabstimmung Der Körper ist in Zwietracht, Antikörper können, anstatt äußere Feinde zu zerstören, als Angreifer auf ihre eigenen Organe und Gewebe des Körpers wirken.

Proteine werden auch in einfache (Proteine) und komplexe (Proteine) unterteilt. Und sie haben Eigenschaften, die nur ihnen innewohnen: Denaturierung (die Zerstörung, die Sie mehr als einmal bemerkt haben, als Sie ein hart gekochtes Ei gekocht haben) und Renaturierung (diese Eigenschaft hat festgestellt Breite Anwendung bei der Herstellung von Antibiotika, Lebensmittelkonzentraten usw.).
Lassen Sie uns nicht ignorieren und Lipide(Fette). In unserem Körper dienen sie als Energiereserve. Als Lösungsmittel helfen sie beim Ablauf biochemischer Reaktionen. Beteiligen Sie sich am Aufbau des Körpers – zum Beispiel an der Bildung von Zellmembranen.
Und noch ein paar Worte zu so merkwürdigen organischen Verbindungen wie Hormone. Sie sind an biochemischen Reaktionen und Stoffwechselvorgängen beteiligt. Diese kleinen Hormone machen Männer zu Männern (Testosteron) und Frauen zu Frauen (Östrogen). Uns glücklich oder traurig machen (Hormone spielen eine wichtige Rolle bei Stimmungsschwankungen) Schilddrüse und Endorphin gibt ein Glücksgefühl). Und sie bestimmen sogar, ob wir „Eulen“ oder „Lerchen“ sind. Sind Sie bereit, spät zu lernen, oder stehen Sie lieber früh auf und tun Hausaufgaben vor der Schule, entscheidet nicht nur Ihr Tagesablauf, sondern auch einige Nebennierenhormone.
Fazit
Die Welt der organischen Materie ist wirklich erstaunlich. Es reicht aus, nur ein wenig in sein Studium einzutauchen, um Ihnen den Atem zu rauben von dem Gefühl der Verwandtschaft mit allem Leben auf der Erde. Zwei Beine, vier oder Wurzeln statt Beine – uns alle eint die Magie des Chemielabors von Mutter Natur. Es bewirkt, dass sich Kohlenstoffatome zu Ketten verbinden, reagieren und Tausende von so unterschiedlichen chemischen Verbindungen bilden.
Sie haben jetzt eine kurze Einführung in die organische Chemie. Natürlich werden hier nicht alle möglichen Informationen dargestellt. Einige Punkte müssen Sie eventuell selbst klären. Sie können aber jederzeit die von uns geplante Route für Ihre eigenständige Recherche nutzen.
Sie können auch die im Artikel angegebene Definition von organischem Material, die Klassifizierung und die allgemeinen Formeln organischer Verbindungen und verwenden allgemeine Informationen um sie auf den Chemieunterricht in der Schule vorzubereiten.
Sagen Sie uns in den Kommentaren, welcher Bereich der Chemie (organisch oder anorganisch) Ihnen am besten gefällt und warum. Vergiss nicht, den Artikel zu teilen in sozialen Netzwerken damit deine Klassenkameraden es auch benutzen können.
Bitte melden Sie uns, wenn Sie Ungenauigkeiten oder Fehler im Artikel finden. Wir sind alle Menschen und wir alle machen manchmal Fehler.
Site, mit vollständigem oder teilweisem Kopieren des Materials, ist ein Link zur Quelle erforderlich.








