أساس اسم المركب هو جذر الكلمة ، الذي يشير إلى الهيدروكربون المشبع بنفس عدد الذرات مثل السلسلة الرئيسية (على سبيل المثال ، met- et-. pro p- ، لكن- ، pent- ، hex -، إلخ.). ويتبع ذلك لاحقة تميز درجة التشبع ، -an ، إذا لم يكن هناك روابط متعددة في الجزيء ، -ene في وجود روابط مزدوجة و -ni للروابط الثلاثية ، على سبيل المثال ، بنتان ، بنتين. إذا كان هناك عدة روابط متعددة في الجزيء ، فسيتم الإشارة إلى عدد هذه الروابط في اللاحقة ، على سبيل المثال: -diene ، -triene ، وبعد اللاحقة ، يجب الإشارة إلى موضع الرابطة المتعددة بالأرقام العربية (لـ مثال ، بيوتين -1 ، بيوتين -2 ، بوتادين -1،3):
CH 3 -CH 2 -CH \ u003d CH 2 CH 3 -CH \ u003d CH-CH 3 CH 2 \ u003d CH-CH \ u003d CH 2
بيوتين - 1 بيوتين - 2 بوتادين - 1،3
علاوة على ذلك ، يتم وضع اسم أقدم مجموعة مميزة في الجزيء في اللاحقة ، مشيرًا إلى موضعها برقم. يتم تحديد البدائل الأخرى بواسطة البادئات. ومع ذلك ، لم يتم سردها بترتيب الأقدمية ، ولكن حسب الترتيب الأبجدي. يُشار إلى موضع البديل برقم قبل البادئة ، على سبيل المثال: 3-methyl؛ 2-الكلورو ومن في حكمه. إذا كان هناك عدة بدائل متطابقة في الجزيء ، فسيتم الإشارة إلى رقمها أمام اسم المجموعة المقابلة (على سبيل المثال ، ثنائي ميثيل ، ثلاثي كلورو ، إلخ). يتم فصل جميع الأرقام في أسماء الجزيئات عن الكلمات بواصلة ، وعن بعضها البعض بفاصلات. الجذور الهيدروكربونية لها أسماء خاصة بها.
الحد من الجذور الهيدروكربونية:
ميثيل إيثيل بروبيل أيزوبروبيل
بوتيل سي-بوتيل
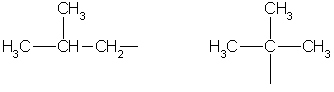
إيزوبوتيل ثلاثي بوتيل
الجذور الهيدروكربونية غير المشبعة:
CH 2 \ u003d CH- HC - C- CH 2 \ u003d CH-CH 2 -
فينيل إيثينيل أليل
الجذور الهيدروكربونية العطرية:

فينيل بنزين
لنأخذ الاتصال التالي كمثال:

اختيار السلسلة لا لبس فيه ، لذلك ، جذر الكلمة مكبوت ، متبوعًا باللاحقة -en ، مما يشير إلى وجود رابطة متعددة ؛ يعطي ترتيب الترقيم أكبر مجموعة (-OH) أقل رقم ؛ ينتهي الاسم الكامل للمركب بلاحقة تدل على مجموعة كبار(في هذه الحالة ، اللاحقة –o l تشير إلى وجود مجموعة الهيدروكسيل) ؛ يشار إلى موضع الرابطة المزدوجة ومجموعة الهيدروكسيل بالأرقام.
لذلك ، يسمى المركب المعطى penten-4-ol-2.
المصطلح البسيط عبارة عن مجموعة من أسماء المركبات العضوية غير المنتظمة التي تم تكوينها تاريخيًا (على سبيل المثال: الأسيتون وحمض الخليك والفورمالديهايد ، وما إلى ذلك). يتم تقديم أهم الأسماء التافهة في النص عند النظر في فئات المركبات المقابلة.
تسمح لك التسمية العقلانية ببناء اسم مادة بناءً على هيكلها باستخدام مركب أبسط يتم اختياره كنموذج أولي. يتم توضيح طريقة هذا البناء من خلال الأمثلة التالية:
تريميثيل ميثاني أسيتيل أسيتون حمض فينيل أسيتيك
تصنيف المواد العضوية أكثر تعقيدًا. هذا يرجع إلى عدد من الأسباب: الوفرة المفرطة للمركبات العضوية ، وتعقيد وتنوع بنيتها ، وتاريخ دراسة مركبات الكربون.في الواقع ، حتى منتصف القرن التاسع عشر. يبدو أن الكيمياء العضوية ، في التعبير المجازي لـ F. Wöhler * ، هي "غابة كثيفة مليئة بالأشياء المدهشة ، غابة لا حدود لها لا يمكنك الخروج منها ، حيث لا تجرؤ على الاختراق." فقط مع ظهور النظرية في عام 1861 التركيب الكيميائيالمركبات العضوية "غابة كثيفة"
الكيمياء العضويةبدأت تتحول إلى غارقة ضوء الشمسمتنزه عادي به شبكة من الأزقة والممرات. كان مؤلفو هذه النظرية ثلاثيًا دوليًا بارزًا لعلماء الكيمياء: مواطننا إيه إم بتليروف ** والألماني إف إيه كيكولي والإنجليزي أ. كوبر.
أرز. 5. فريدريش فولر
(1800–1882)

أرز. 6. الكسندر
ميخائيلوفيتش بتليروف
(1828–1886)
يمكن صياغة جوهر نظرية التركيب الكيميائي الذي أنشأوه في شكل ثلاث افتراضات.
1. ترتبط الذرات في الجزيئات بترتيب معين وفقًا لتكافؤها ، ويكون الكربون في المركبات العضوية رباعي التكافؤ.
2. لا يتم تحديد خصائص المواد فقط من خلال التركيب النوعي والكمي للعناصر ، ولكن أيضًا بترتيب روابط الذرات في الجزيئات ، أي التركيب الكيميائي.
3. الذرات في الجزيئات لها تأثير متبادل على بعضها البعض ، مما يؤثر على خصائص المواد.
* كيميائي ألماني. أجرى بحثا في مجال الكيمياء العضوية وغير العضوية. ثبت وجود ظاهرة الايزومرية ، ولأول مرة نفذت تصنيع المواد العضوية (اليوريا) من غير العضوية. حصل على بعض المعادن (الألمنيوم ، البريليوم ، إلخ).
** كيميائي روسي متميز مؤلف نظرية الكيمياء
هيكل المادة العضوية. مرتكز علىمفاهيم التركيب أوضحت ظاهرة التماكب ، وتوقعت وجود ايزومرات لعدد من المواد وصنعها لأول مرة. كان أول من صنع مادة سكرية. مؤسس مدرسة الكيمياء الروسيةkov ، والتي تضمنت V.V. Markovnikov ، و AM Zaitsev ، و E.E. Wagner ، و A.
يبدو اليوم أنه من غير المعقول أنه حتى منتصف القرن التاسع عشر ، خلال فترة الاكتشافات العظيمة في العلوم الطبيعية ، كان لدى العلماء فكرة ضعيفة عن البنية الداخلية للمادة. كان بتليروف هو من أدخل مصطلح "التركيب الكيميائي" ، بمعنى أنه نظام من الروابط الكيميائية بين الذرات في الجزيء ، الترتيب المتبادلفي الفضاء. بفضل هذا الفهم لبنية الجزيء ، أصبح من الممكن شرح ظاهرة التماثل ، والتنبؤ بوجود أيزومرات غير معروفة ، وربط خصائص المواد بتركيبها الكيميائي. كتوضيح لظاهرة الأيزومرية ، نقدم صيغ وخصائص مادتين - كحول الإيثيل وثنائي ميثيل الأثير ، اللذان لهما نفس التركيب الأولي لـ C2H6O ، لكن لهما تركيبات كيميائية مختلفة (الجدول 2).
الجدول 2
رسم توضيحي لاعتماد خصائص مادة مامن هيكلها

تعد ظاهرة التماثل المنتشر بشكل كبير في الكيمياء العضوية أحد أسباب تنوع المواد العضوية. سبب آخر لتنوع المواد العضوية يكمن في القدرة الفريدة لذرة الكربون على تكوين روابط كيميائية مع بعضها البعض ، مما يؤدي إلى سلاسل الكربون.
أطوال وهياكل مختلفة: غير متفرعة ، متفرعة ، مغلقة. على سبيل المثال ، يمكن لأربع ذرات كربون أن تشكل سلاسل مثل هذه:

إذا أخذنا في الاعتبار أنه بين ذرتين من الكربون لا يمكن أن يكون هناك روابط C-C بسيطة (مفردة) فحسب ، بل أيضًا مزدوجة C = C وثلاثية C≡C ، ثم عدد المتغيرات من سلاسل الكربون ، وبالتالي ، عضوي مختلف المواد تزيد بشكل كبير.
يعتمد تصنيف المواد العضوية أيضًا على نظرية بتليروف للتركيب الكيميائي. اعتمادا على الذرات العناصر الكيميائيةهي جزء من الجزيء ، وجميع المجموعات العضوية الكبيرة: الهيدروكربونات ، والمركبات المحتوية على الأكسجين ، والمركبات المحتوية على النيتروجين.
الهيدروكربونات مركبات عضوية تتكون فقط من ذرات الكربون والهيدروجين.
وفقًا لهيكل سلسلة الكربون ، ووجود أو عدم وجود روابط متعددة فيها ، يتم تقسيم جميع الهيدروكربونات إلى عدة فئات. هذه الفئات موضحة في الشكل 2.
إذا كان الهيدروكربون لا يحتوي على روابط متعددة وسلسلة ذرات الكربون غير مغلقة ، فإنها تنتمي ، كما تعلم ، إلى فئة الهيدروكربونات المشبعة ، أو الألكانات. أصل هذه الكلمة عربي ، واللاحقة -en موجودة في أسماء جميع الهيدروكربونات من هذه الفئة.
مخطط 2
تصنيف الهيدروكربون

إن وجود رابطة مزدوجة واحدة في جزيء الهيدروكربون يجعل من الممكن نسبتها إلى فئة الألكينات ، ويتم التأكيد على علاقتها بهذه المجموعة من المواد
اللاحقة -en في الاسم. أبسط ألكين هو الإيثيلين ، والذي له الصيغة CH2 = CH2. يمكن أن يكون هناك رابطان مزدوجان C = C في جزيء ، وفي هذه الحالة تنتمي المادة إلى فئة الكاديين.
حاول أن تشرح معنى اللواحق -dienes نفسك. على سبيل المثال ، يحتوي butadiene-1،3 على الصيغة البنائية: CH2 = CH – CH = CH2.
تسمى الهيدروكربونات ذات الروابط الثلاثية بين الكربون والكربون في الجزيء الألكينات. تشير اللاحقة -in إلى الانتماء إلى هذه الفئة من المواد. سلف فئة الألكينات هو الأسيتيلين (ethyne) ، الصيغة الجزيئية منها C2H2 ، والصيغة البنائية هي HC≡CH. من المركبات ذات السلسلة الكربونية المغلقة
أهم الذرات هي الساحات - فئة خاصة من الهيدروكربونات ، اسم الممثل الأول الذي ربما سمعت عنه - هذا هو البنزين C6H6 ، الصيغة الهيكلية معروفة أيضًا لكل شخص مثقف:

كما فهمت بالفعل ، بالإضافة إلى الكربون والهيدروجين ، يمكن أن تشتمل تركيبة المواد العضوية على ذرات عناصر أخرى ، خاصة الأكسجين والنيتروجين. في أغلب الأحيان ، تشكل ذرات هذه العناصر في مجموعات مختلفة مجموعات تسمى وظيفية.
المجموعة الوظيفية هي مجموعة من الذرات التي تحدد أكثر الخصائص الخواص الكيميائيةالمواد وانتمائها إلى فئة معينة من المركبات.
يتم عرض الفئات الرئيسية للمركبات العضوية التي تحتوي على مجموعات وظيفية في المخطط 3.
مخطط 3
الفئات الرئيسية للمواد العضوية التي تحتوي على مجموعات وظيفية

تسمى المجموعة الوظيفية -OH الهيدروكسيل وتحدد الانتماء إلى واحدة من أهم فئات المواد العضوية - الكحولات.
يتم تشكيل أسماء الكحولات باستخدام اللاحقة -ol. على سبيل المثال ، أشهر ممثل للكحوليات هو الإيثانول، أو الإيثانول ، C2H5OH.
يمكن ربط ذرة الأكسجين بذرة كربون بواسطة رابطة كيميائية مزدوجة. المجموعة> C = O تسمى كاربونيل. مجموعة كاربونيل هي جزء من عدة
المجموعات الوظيفية ، بما في ذلك الألدهيد والكربوكسيل. المركبات العضوية التي تحتوي على هذه المجموعات الوظيفية تسمى الألدهيدات والأحماض الكربوكسيلية ، على التوالي. أشهر ممثلي الألدهيدات هم الفورمالديهايد HCO وأسيتالديهيد CH3COH. مع حمض الاسيتيك CH3COOH ، الذي يسمى حله بخل المائدة ، ربما يكون مألوفًا للجميع. السمة الهيكلية المميزة للمركبات العضوية المحتوية على النيتروجين ، وقبل كل شيء ، الأمينات والأحماض الأمينية ، هي وجود المجموعة الأمينية –NH2 في جزيئاتها.
التصنيف أعلاه للمواد العضوية نسبي أيضًا. مثلما يمكن أن يحتوي جزيء واحد (على سبيل المثال ، alkadienes) على رابطتين متعددتين ، يمكن أن تكون المادة مالكة لمجموعتين وظيفيتين أو أكثر. لذا، الوحدات الهيكليةالناقلات الرئيسية للحياة على الأرض - جزيئات البروتين - هي الأحماض الأمينية. تحتوي جزيئات هذه المواد بالضرورة على مجموعتين وظيفيتين على الأقل - مجموعة الكربوكسيل والأمينية. يُطلق على أبسط حمض أميني اسم الجلايسين وله الصيغة:

مثل هيدروكسيدات الأمفوتريك ، تجمع الأحماض الأمينية بين خصائص الأحماض (بسبب مجموعة الكربوكسيل) والقواعد (بسبب وجود مجموعة أمينية في الجزيء).
لتنظيم الحياة على الأرض ، فإن الخصائص المذبذبة للأحماض الأمينية لها أهمية خاصة - بسبب تفاعل المجموعات الأمينية ومجموعات الكربوكسيل من الأحماض الأمينية.
ترتبط الكثير في سلاسل البروتينات البوليمرية.
؟ 1. ما هي الأحكام الرئيسية لنظرية التركيب الكيميائي لـ A.M. Butlerov. ما الدور الذي لعبته هذه النظرية في تطوير الكيمياء العضوية؟
2. ما هي فئات الهيدروكربونات التي تعرفها؟ على أي أساس تم هذا التصنيف؟
3. ما يسمى بالمجموعة الوظيفية لمركب عضوي؟ ما هي المجموعات الوظيفية التي يمكنك تسميتها؟ ما هي فئات المركبات العضوية التي تحتوي على هذه المجموعات الوظيفية؟ اكتب الصيغ العامةفئات المركبات والصيغ لممثليهم.
4. أعط تعريفًا للتشابه ، اكتب صيغ الأيزومرات الممكنة لمركبات تكوين C4H10O. باستخدام مصادر المعلومات المختلفة ، قم بتسمية كل منها وإعداد تقرير عن أحد المجمعات.
5. خصص المواد التي تكون صيغها: C6H6 ، C2H6 ، C2H4 ، HCOOH ، CH3OH ، C6H12O6 للفئات المقابلة من المركبات العضوية. باستخدام مصادر المعلومات المختلفة ، قم بتسمية كل منها وإعداد تقرير عن أحد المجمعات.
6. الصيغة التركيبية للجلوكوز:  إلى أي فئة من المركبات العضوية ستصنف هذه المادة؟ لماذا يطلق عليه مركب ذو وظيفة مزدوجة؟
إلى أي فئة من المركبات العضوية ستصنف هذه المادة؟ لماذا يطلق عليه مركب ذو وظيفة مزدوجة؟
7. قارن المركبات الأمفوتيرية العضوية وغير العضوية.
8. لماذا يشار إلى الأحماض الأمينية بمركبات ذات وظيفة مزدوجة؟ ما الدور الذي تلعبه هذه الميزة الهيكلية للأحماض الأمينية في تنظيم الحياة على الأرض؟
9. قم بإعداد رسالة حول موضوع "الأحماض الأمينية هي" لبنات "الحياة باستخدام إمكانيات الإنترنت.
10. أعط أمثلة على النسبية لتقسيم المركبات العضوية إلى فئات معينة. ارسم موازيات نسبية مماثلة للمركبات غير العضوية.
أبسط تصنيف هو أن جميع المواد المعروفة مقسمة إلى عضوي وغير عضوي. المواد العضوية الهيدروكربوناتومشتقاتها. جميع المواد الأخرى غير عضوية.

لا المواد العضوية مقسمة إلى تكوين بسيطة ومعقدة.

مواد بسيطةتتكون من ذرات عنصر كيميائي واحد وتنقسم إلى معادن وغير فلزية وغازات نبيلة. تتكون المركبات من ذرات من عناصر مختلفة مرتبطة كيميائيًا ببعضها البعض.
تنقسم المواد غير العضوية المعقدة وفقًا لتكوينها وخصائصها إلى الفئات الرئيسية التالية: أكاسيد ، قواعد ، أحماض ، هيدروكسيدات مذبذبة ، أملاح.
- أكاسيد- هذه مواد معقدة تتكون من عنصرين كيميائيين أحدهما أكسجين له حالة أكسدة (-2). الصيغة العامة للأكاسيد هي: E m O n ، حيث m هو عدد ذرات العنصر E ، و n هو عدد ذرات الأكسجين. الأكاسيد ، بدورها ، تصنف إلى مكونة للملح وغير مكونة للملح. تنقسم المواد المكونة للملح إلى قاعدية ، مذبذبة ، حمضية ، والتي تتوافق مع القواعد ، هيدروكسيدات مذبذبة ، أحماض ، على التوالي.
- أكاسيد أساسيةهي أكاسيد المعادن في حالات الأكسدة +1 و +2. وتشمل هذه:
- أكاسيد المعادن من المجموعة الفرعية الرئيسية للمجموعة الأولى ( الفلزات القلوية) لي الاب
- أكاسيد المعادن من المجموعة الفرعية الرئيسية للمجموعة الثانية ( المغنيسيوم والمعادن الأرضية القلوية) إم جي رع
- أكاسيد المعادن الانتقالية في حالات الأكسدة المنخفضة
- أكاسيد حامضية- تشكيل غير المعادن مع S.O. أكثر من +2 والمعادن مع S.O. من +5 إلى +7 (SO 2 و SeO 2 و P 2 O 5 و As 2 O 3 و CO 2 و SiO 2 و CrO 3 و Mn 2 O 7). استثناء: لا أكاسيد 2 و ClO 2 لا توجد هيدروكسيدات حمضية مقابلة ، لكنها تعتبر حمضية.
- أكاسيد الأمفوتريك- يتكون من معادن مذبذبة مع S.O. +2 و +3 و +4 (BeO و Cr 2 O 3 و ZnO و Al 2 O 3 و GeO 2 و SnO 2 و PbO).
- أكاسيد غير مكونة للملح- أكاسيد غير الفلزات مع С.О. + 1 ، +2 (СО ، NO ، N 2 O ، SiO).
- أسس- هذه مواد معقدة تتكون من ذرات معدنية ومجموعة هيدروكسو واحدة أو أكثر (-OH). الصيغة العامة للقواعد: M (OH) y ، حيث y هو عدد مجموعات الهيدروكسو ، درجة متساويةأكسدة المعدن M (عادة +1 و +2). تنقسم القواعد إلى قابل للذوبان (قلوي) وغير قابل للذوبان.
- الأحماض- (هيدروكسيدات الحمض) عبارة عن مواد معقدة تتكون من ذرات هيدروجين يمكن استبدالها بذرات معدنية وبقايا حمضية. الصيغة العامة للأحماض: H x Ac ، حيث Ac عبارة عن بقايا حمضية (من "الحمض" الإنجليزي - حمض) ، x هو عدد ذرات الهيدروجين التي تساوي شحنة أيون بقايا الحمض.
- هيدروكسيدات أمفوتيريةهي مواد معقدة تظهر خصائص الأحماض وخصائص القواعد. لذلك ، يمكن كتابة صيغ الهيدروكسيدات المذبذبة في شكل أحماض وفي شكل قواعد.
- ملح- هذه مواد معقدة تتكون من كاتيونات معدنية وأنيونات بقايا حمضية. ينطبق هذا التعريف على الأملاح المتوسطة.
- أملاح متوسطة- هذه هي منتجات الاستبدال الكامل لذرات الهيدروجين في جزيء الحمض بواسطة ذرات معدنية أو الاستبدال الكامل لمجموعات الهيدروكسو في الجزيء الأساسي بمخلفات حمضية.
- الأملاح الحمضية- يتم استبدال ذرات الهيدروجين في الحمض جزئيًا بذرات معدنية. يتم الحصول عليها عن طريق تحييد قاعدة تحتوي على حمض زائد. لتسمية بشكل صحيح ملح حامض ،من الضروري إضافة البادئة hydro- أو dihydro- إلى اسم الملح العادي ، اعتمادًا على عدد ذرات الهيدروجين التي يتكون منها الملح الحمضي. على سبيل المثال ، KHCO 3 عبارة عن بيكربونات البوتاسيوم ، KH 2 PO 4 هو ثنائي هيدروورثوفوسفات البوتاسيوم . يجب أن نتذكر ذلك الأملاح الحمضيةيمكن أن تشكل فقط اثنين أو أكثر من الأحماض الأساسية.
- أملاح أساسية- يتم استبدال مجموعات الهيدروكسو للقاعدة (OH -) جزئيًا بمخلفات حمضية. لتسمية ملح أساسي ،من الضروري إضافة البادئة hydroxo- أو dihydroxo- إلى اسم الملح العادي ، اعتمادًا على عدد مجموعات OH التي يتكون منها الملح. على سبيل المثال ، (CuOH) 2 CO 3 هو النحاس (II) hydroxocarbonate. يجب أن نتذكر أن الأملاح الأساسية يمكن أن تشكل فقط قواعد تحتوي على مجموعتين أو أكثر من مجموعات الهيدروكسو.
- أملاح مزدوجة- يوجد في تكوينهما كاتيونات مختلفة ، يتم الحصول عليها عن طريق التبلور من محلول مختلط من الأملاح مع كاتيونات مختلفة ، ولكن نفس الأنيونات. على سبيل المثال ، KAl (SO 4) 2 ، KNaSO 4.
- أملاح مختلطة- في تكوينها هناك نوعان من الأنيونات المختلفة. على سبيل المثال ، Ca (OCl) Cl.
- أملاح الهيدرات (هيدرات الكريستال) - تشمل جزيئات ماء التبلور. مثال: Na 2 SO 4 10H 2 O.

تصنيف المواد العضوية
تسمى المركبات التي تحتوي على ذرات الهيدروجين والكربون فقط الهيدروكربونات. قبل البدء في هذا القسم ، تذكر ، لتبسيط السجل ، أن الكيميائيين لا يرسمون ذرات الكربون والهيدروجين في سلاسل ، لكن لا تنس أن الكربون يشكل أربعة روابط ، وإذا كان الكربون في الشكل مرتبطًا برابطة اثنين ، فإنه ملزم برقمين المزيد من الروابط مع الهيدروجين ، على الرغم من أنها الأخيرة وغير مذكورة:

اعتمادًا على هيكل سلسلة الكربون ، يتم تقسيم المركبات العضوية إلى مركبات ذات سلسلة مفتوحة - لا دوري(أليفاتية) و دوري- بسلسلة ذرات مغلقة.
دوريتنقسم إلى مجموعتين: الكربوهيدرات الحلقيةوصلات و غير متجانسة.
المركبات الكربونية الحلقية، بدورها ، تشمل سلسلتين من المركبات: أليكسليكو عطري.
المركبات العطريةيعتمد هيكل الجزيئات على دورات تحتوي على كربون مسطح مع نظام مغلق خاص من الإلكترونات π. تشكيل نظام π مشترك (سحابة إلكترون واحدة).

يمكن أن تحتوي كل من الهيدروكربونات الحلقية (الأليفاتية) والحلقة على روابط متعددة (مزدوجة أو ثلاثية). تسمى هذه الهيدروكربونات غير محدود(غير مشبع) ، على عكس هامش(مشبع) يحتوي على روابط مفردة فقط.
Pi-bond (π-bond) - رابطة تساهمية تتكون من تداخل المدارات الذرية p. على النقيض من رابطة سيجما ، والتي تحدث عندما تتداخل مدارات s-atomic على طول خط الرابطة الذرية ، تحدث روابط pi عندما تتداخل مدارات p-atomic على جانبي خط الرابطة الذرية.
في حالة تكوين نظام عطري ، على سبيل المثال ، البنزين C6H6 ، تكون كل ذرة من ذرات الكربون الست في حالة sp2 - تهجين وتشكل ثلاث روابط سيجما بزوايا رابطة تبلغ 120 درجة. يتم توجيه الإلكترون الرابع من كل ذرة كربون عموديًا على مستوى حلقة البنزين. بشكل عام ، تنشأ رابطة واحدة تمتد إلى جميع ذرات الكربون في حلقة البنزين. يتم تشكيل منطقتين من روابط pi ذات الكثافة الإلكترونية العالية على جانبي مستوى روابط سيجما. مع مثل هذه الرابطة ، تصبح جميع ذرات الكربون في جزيء البنزين متكافئة ، وبالتالي ، فإن مثل هذا النظام يكون أكثر استقرارًا من النظام الذي يحتوي على ثلاث روابط مزدوجة محلية.

تسمى الهيدروكربونات الأليفاتية المحدودة الألكانات ، ولها الصيغة العامة C n H 2n + 2 ، حيث n هو عدد ذرات الكربون. غالبًا ما يستخدم الاسم القديم اليوم - البارافينات:
تسمى الهيدروكربونات الأليفاتية غير المشبعة مع رابطة ثلاثية واحدة الألكينات. صيغتها العامة C n H 2n - 2
الحد من الهيدروكربونات الأليفية الحلقية - الألكانات الحلقية ، وصيغتها العامة هي C n H 2n:

لقد نظرنا في تصنيف الهيدروكربونات. ولكن إذا كان في هذه الجزيئات واحد أو أكثريتم استبدال ذرات الهيدروجين بذرات أو مجموعات ذرات أخرى (الهالوجينات ، مجموعات الهيدروكسيل ، المجموعات الأمينية ، إلخ) ، يتم تكوين مشتقات الهيدروكربونات: مشتقات الهالوجين ، المحتوية على الأكسجين ، المحتوية على النيتروجين والمركبات العضوية الأخرى.

تسمى الذرات أو مجموعات الذرات التي تحدد الخصائص الأكثر تميزًا لفئة معينة من المواد بالمجموعات الوظيفية.
تشكل الهيدروكربونات في مشتقاتها مع نفس المجموعة الوظيفية سلسلة متجانسة.
السلسلة المتماثلة هي سلسلة من المركبات التي تنتمي إلى نفس الفئة (متجانسات) ، تختلف عن بعضها البعض في التركيب بعدد صحيح من -CH 2 - مجموعات (فرق متماثل) ، لها بنية متشابهة ، وبالتالي ، خصائص كيميائية متشابهة.
إن تشابه الخصائص الكيميائية للمتماثلات يبسط إلى حد كبير دراسة المركبات العضوية.
الهيدروكربونات المستبدلة
- مشتقات الهالوجين من الهيدروكربوناتيمكن اعتبارها منتجات للإحلال في الهيدروكربونات لواحدة أو أكثر من ذرات الهيدروجين بواسطة ذرات الهالوجين. وفقًا لهذا ، يمكن أن توجد مشتقات هالوجين أحادية مشبعة وغير مشبعة (بشكل عام بولي). ، الإيثرات والإسترات.
- كحول- مشتقات الهيدروكربونات التي يتم فيها استبدال ذرة هيدروجين واحدة أو أكثر بمجموعات الهيدروكسيل. تسمى الكحولات أحادية الهيدروكسيل إذا كانت تحتوي على مجموعة هيدروكسيل واحدة ، وتحد إذا كانت من مشتقات الألكانات. الصيغة العامة للحد الكحولات أحادية الماء: R-OH.
- الفينولات- مشتقات الهيدروكربونات العطرية (سلسلة البنزين) ، حيث يتم استبدال واحدة أو أكثر من ذرات الهيدروجين في حلقة البنزين بمجموعات الهيدروكسيل.
- الألدهيدات والكيتونات- مشتقات الهيدروكربونات التي تحتوي على مجموعة ذرات كربونيل (كاربونيل). في جزيئات الألدهيد ، يذهب أحد روابط الكربونيل إلى الوصلة مع ذرة هيدروجين ، والآخر - مع جذر هيدروكربوني. في حالة الكيتونات ، ترتبط مجموعة الكربونيل مع اثنان (مختلفان عمومًا) من الجذور.
- الاثيراتهي مواد عضوية تحتوي على جزأين هيدروكربونيين متصلين بواسطة ذرة أكسجين: R = O-R أو R-O-R 2. يمكن أن تكون الجذور متماثلة أو مختلفة. يتم التعبير عن تكوين الإيثرات بالصيغة C n H 2n + 2O.
- استرات- المركبات المتكونة باستبدال ذرة الهيدروجين من مجموعة الكربوكسيل في الأحماض الكربوكسيليةلجذر الهيدروكربون.
- مركبات النيترو- مشتقات الهيدروكربونات التي يتم فيها استبدال ذرة هيدروجين واحدة أو أكثر بمجموعة نيترو- NO 2.
- الأمينات- المركبات التي تعتبر من مشتقات الأمونيا ، حيث يتم استبدال ذرات الهيدروجين بجذور الهيدروكربون ، اعتمادًا على طبيعة الجذر ، يمكن أن تكون الأمينات أليفاتية. اعتمادًا على عدد ذرات الهيدروجين التي تم استبدالها بالجذور ، يتم تمييز الأمينات الأولية والثانوية والثالثية. في حالة معينة ، قد يكون للأمينات الثانوية والثالثية نفس الجذور. يمكن أيضًا اعتبار الأمينات الأولية كمشتقات للهيدروكربونات (الألكانات) حيث يتم استبدال ذرة هيدروجين بمجموعة أمينية. تحتوي الأحماض الأمينية على مجموعتين وظيفيتين متصلتين بجذر هيدروكربوني - مجموعة أمينية - NH 2 وكربوكسيل - COOH.
من المعروف أن المركبات العضوية الهامة الأخرى لها عدة مجموعات وظيفية مختلفة أو متطابقة ، سلاسل خطية طويلة مرتبطة بحلقات البنزين. في مثل هذه الحالات ، من المستحيل وضع تعريف صارم لما إذا كانت مادة ما تنتمي إلى فئة معينة. غالبًا ما يتم عزل هذه المركبات في مجموعات محددة من المواد: الكربوهيدرات والبروتينات ، احماض نووية، والمضادات الحيوية ، والقلويدات ، وما إلى ذلك. حاليا ، هناك أيضا العديد من المركبات التي يمكن أن تعزى إلى كل من العضوية وغير العضوية. يطلق عليهم مركبات عضوية. يمكن اعتبار بعضها كمشتقات للهيدروكربونات.
التسمية
يتم استخدام تسميتين لتسمية المركبات العضوية - أسماء عقلانية ومنهجية (IUPAC) وتافهة.

تجميع الأسماء وفقًا لتسمية IUPAC:
1) أساس اسم المركب هو جذر الكلمة ، الذي يشير إلى الهيدروكربون المشبع بنفس عدد الذرات مثل السلسلة الرئيسية.
2) تضاف لاحقة إلى الجذر ، تميز درجة التشبع:
و (محدد ، لا توجد سندات متعددة) ؛
يونغ (في وجود رابطة مزدوجة) ؛
ينج (في وجود رابطة ثلاثية).

إذا كان هناك عدة روابط متعددة ، فسيتم الإشارة إلى عدد هذه السندات (-diene ، -triene ، إلخ) في اللاحقة ، وبعد اللاحقة ، يجب الإشارة إلى موضع الرابطة المتعددة بالأرقام ، على سبيل المثال:
CH 3 -CH 2 -CH \ u003d CH 2 CH 3 -CH \ u003d CH -CH 3
بيوتين -1 بيوتين -2
CH 2 \ u003d CH - CH \ u003d CH 2
يتم أخذ مجموعات مثل النيترو والهالوجينات والجذور الهيدروكربونية غير المدرجة في السلسلة الرئيسية إلى البادئة. تم سردها في الترتيب الأبجدي. يُشار إلى موضع البديل برقم قبل البادئة.
ترتيب العنوان كما يلي:
1. أوجد أطول سلسلة من ذرات الكربون.
2. قم بترقيم ذرات الكربون بالتتابع في السلسلة الرئيسية ، بدءًا من النهاية الأقرب للفرع.
3. يتكون اسم الألكان من أسماء الجذور الجانبية ، مدرجة بالترتيب الأبجدي ، تشير إلى الموضع في السلسلة الرئيسية ، واسم السلسلة الرئيسية.
 ترتيب التسمية
ترتيب التسمية اللغة الكيميائية ، والتي ، باعتبارها واحدة من أكثر الأجزاء تحديدًا ، تتضمن الرموز الكيميائية (بما في ذلك و الصيغ الكيميائية) ، هي وسيلة فعالة ومهمة لتعلم الكيمياء وبالتالي تتطلب تطبيقًا واضحًا وواعيًا.
الصيغ الكيميائية- هذه صور شرطية لتكوين وهيكل المواد الفردية كيميائيًا من خلال الرموز الكيميائية والمؤشرات والعلامات الأخرى. عند دراسة التركيب والتركيب الكيميائي والإلكتروني والمكاني للمواد وخواصها الفيزيائية والكيميائية والتشابه والظواهر الأخرى ، يتم استخدام الصيغ الكيميائية من أنواع مختلفة.
يتم استخدام العديد من أنواع الصيغ على وجه الخصوص (أبسط ، جزيئية ، هيكلية ، إسقاط ، توافقي ، إلخ) في دراسة مواد التركيب الجزيئي - معظم المواد العضوية وجزء صغير نسبيًا من المواد غير العضوية في ظل الظروف العادية. يتم استخدام أنواع أقل بكثير من الصيغ (أبسطها) في دراسة المركبات غير الجزيئية ، والتي ينعكس هيكلها بشكل أكثر وضوحًا في نماذج الكرة والعصا ومخططات الهياكل البلورية أو خلايا الوحدة الخاصة بها.

رسم الصيغ التركيبية الكاملة والقصيرة للهيدروكربونات
مثال:
اكتب بشكل كامل وموجز الصيغ الهيكليةالبروبان C 3 H 8.
حل:
1. اكتب 3 ذرات كربون في خط ، واربطها بالسندات:
S –S – S
2. أضف شرطات (روابط) بحيث تمتد 4 روابط من كل ذرة كربون:


4. اكتب صيغة هيكلية موجزة:
CH 3 -CH 2 -CH 3
جدول الذوبان
تُصنف المركبات العضوية وفقًا لميزتين هيكليتين رئيسيتين:
هيكل سلسلة الكربون (الهيكل الكربوني) ؛
وجود وهيكل المجموعات الوظيفية.
الهيكل العظمي الكربوني (سلسلة الكربون) - سلسلة من ذرات الكربون المرتبطة كيميائياً.
المجموعة الوظيفية - ذرة أو مجموعة ذرات تحدد ما إذا كان المركب ينتمي إلى فئة معينة ومسؤول عن خواصه الكيميائية.
تصنيف المركبات حسب هيكل سلسلة الكربون
اعتمادًا على هيكل سلسلة الكربون ، تنقسم المركبات العضوية إلى حلقية ودورية.
المركبات غير الحلقية - المركبات ذات يفتح(مفتوحة) سلسلة الكربون. تسمى هذه الاتصالات أيضًا أليفاتية.
من بين المركبات غير الحلقية ، يتم تمييز المركبات المقيدة (المشبعة) ، وتحتوي على مركبات مفردة فقط في الهيكل العظمي اتصالات C-Cو غير محدود(غير مشبعة) ، بما في ذلك الروابط المتعددة C = C و C C.
مركبات لا حلقية
حد:

غير محدود:

تنقسم المركبات غير الحلقية أيضًا إلى مركبات غير متفرعة و سلسلة متفرعة. في هذه الحالة ، يتم أخذ عدد روابط ذرة الكربون مع ذرات الكربون الأخرى في الاعتبار.
السلسلة ، التي تشمل ذرات الكربون من الدرجة الثالثة أو الرباعية ، متفرعة (غالبًا ما يُشار إليها بالبادئة "iso" في الاسم).
على سبيل المثال:

ذرات الكربون:
أساسي؛
ثانوي؛
بعد الثانوي.
المركبات الحلقية هي مركبات ذات سلسلة كربون مغلقة.
اعتمادًا على طبيعة الذرات التي تتكون منها الدورة ، يتم تمييز المركبات الحلقية الكربونية وغير المتجانسة.
تحتوي المركبات الكربونية الحلقية على ذرات كربون فقط في الدورة. وهي مقسمة إلى مجموعتين تختلفان اختلافًا كبيرًا في الخواص الكيميائية: الأليفاتية الحلقية - الأليفاتية الحلقية - للمركبات القصيرة - والمركبات العطرية.
المركبات الكربونية الحلقية
أليسيكليك:

عطرية:

تحتوي المركبات الحلقية غير المتجانسة في الدورة ، بالإضافة إلى ذرات الكربون ، على ذرة واحدة أو أكثر من العناصر الأخرى - الذرات غير المتجانسة(من اليونانية. مغاير- أخرى ، مختلفة) - أكسجين ، نيتروجين ، كبريت ، إلخ.
المركبات الحلقية غير المتجانسة

تصنيف المركبات حسب المجموعات الوظيفية
المركبات التي تحتوي فقط على الكربون والهيدروجين تسمى الهيدروكربونات.
يمكن اعتبار المركبات العضوية الأخرى ، الأكثر عددًا ، كمشتقات للهيدروكربونات ، والتي تتشكل عندما يتم إدخال مجموعات وظيفية تحتوي على عناصر أخرى في الهيدروكربونات.
اعتمادًا على طبيعة المجموعات الوظيفية ، يتم تقسيم المركبات العضوية إلى فئات. يتم عرض بعض المجموعات الوظيفية الأكثر تميزًا وفئات المركبات المقابلة لها في الجدول:
أصناف المركبات العضوية

ملاحظة: يشار إلى المجموعات الوظيفية أحيانًا بالروابط المزدوجة والثلاثية.
قد تحتوي جزيئات المركبات العضوية على مجموعتين أو أكثر من المجموعات الوظيفية المتماثلة أو المختلفة.
على سبيل المثال: HO-CH 2 -CH 2 -OH (ethylene glycol) ؛ NH 2 -CH 2 - COOH (حمض أميني جليكاين).
جميع فئات المركبات العضوية مترابطة. يتم الانتقال من فئة واحدة من المركبات إلى أخرى بشكل أساسي بسبب تحول المجموعات الوظيفية دون تغيير الهيكل الكربوني. تشكل مركبات كل فئة سلسلة متجانسة.
في الماضي ، قسّم العلماء جميع المواد الموجودة في الطبيعة إلى جماد مشروط وحي ، بما في ذلك الممالك الحيوانية والنباتية بين هذه الأخيرة. تسمى مواد المجموعة الأولى المعدنية. وأولئك الذين دخلوا الثانية ، بدأوا يطلق عليهم المواد العضوية.
ما هو المقصود من هذا؟ فئة المواد العضوية هي الأكثر شمولاً بين الجميع مركبات كيميائيةمعروف لدى العلماء المعاصرين. يمكن الإجابة عن السؤال المتعلق بالمواد العضوية على النحو التالي - وهي مركبات كيميائية تشتمل على الكربون.
يرجى ملاحظة أنه ليست كل المركبات المحتوية على الكربون عضوية. على سبيل المثال ، الكاربيدات والكربونات وحمض الكربونيك والسيانيدات وأكاسيد الكربون ليست من بينها.
لماذا يوجد الكثير من المواد العضوية؟
تكمن الإجابة على هذا السؤال في خصائص الكربون. هذا العنصر غريب لأنه قادر على تكوين سلاسل من ذراته. وفي الوقت نفسه ، فإن رابطة الكربون مستقرة جدًا.
بالإضافة إلى ذلك ، في المركبات العضوية ، يظهر التكافؤ العالي (IV) ، أي القدرة على تكوين روابط كيميائية مع مواد أخرى. وليس فقط مفردة ، ولكن أيضًا مزدوجة وحتى ثلاثية (خلاف ذلك - مضاعفات). مع زيادة تعدد الرابطة ، تصبح سلسلة الذرات أقصر ، ويزداد استقرار الرابطة.
ويتمتع الكربون بالقدرة على تكوين هياكل خطية ومسطحة وثلاثية الأبعاد.
هذا هو السبب في أن المواد العضوية في الطبيعة متنوعة للغاية. يمكنك التحقق من ذلك بنفسك بسهولة: قف أمام المرآة وانظر بعناية إلى انعكاسك. كل واحد منا هو كتاب مدرسي يمشي في الكيمياء العضوية. فكر في الأمر: 30٪ على الأقل من كتلة كل خلية من خلاياك عبارة عن مركبات عضوية. البروتينات التي كونت جسمك. الكربوهيدرات التي تعمل "كوقود" ومصدر للطاقة. الدهون التي تخزن احتياطيات الطاقة. الهرمونات التي تتحكم في وظائف الأعضاء وحتى سلوكك. الانزيمات التي تبدأ تفاعلات كيميائيةبداخلك. وحتى "الكود المصدري" ، خيوط الحمض النووي ، كلها مركبات عضوية قائمة على الكربون.
تكوين المواد العضوية
كما قلنا في البداية ، فإن مادة البناء الرئيسية للمواد العضوية هي الكربون. وعمليًا ، يمكن لأي عناصر ، تتحد مع الكربون ، أن تشكل مركبات عضوية.
في الطبيعة ، غالبًا ما يكون في تكوين المواد العضوية الهيدروجين والأكسجين والنيتروجين والكبريت والفوسفور.
هيكل المواد العضوية
يمكن تفسير تنوع المواد العضوية على هذا الكوكب وتنوع بنيتها السمات المميزةذرات الكربون.
تتذكر أن ذرات الكربون قادرة على تكوين روابط قوية جدًا مع بعضها البعض ، متصلة بالسلاسل. والنتيجة هي جزيئات مستقرة. الطريقة التي ترتبط بها ذرات الكربون في سلسلة (مرتبة في نمط متعرج) هي واحدة من السمات الرئيسية لهيكلها. يمكن أن يتحد الكربون في سلاسل مفتوحة وفي سلاسل مغلقة (دورية).
من المهم أيضًا أن يكون الهيكل مواد كيميائيةتؤثر بشكل مباشر على خصائصها الكيميائية. يلعب دور مهم أيضًا في كيفية تأثير الذرات ومجموعات الذرات في الجزيء على بعضها البعض.
نظرًا لخصائص الهيكل ، فإن عدد مركبات الكربون من نفس النوع يذهب إلى عشرات ومئات. على سبيل المثال ، يمكننا اعتبار مركبات الهيدروجين من الكربون: الميثان ، والإيثان ، والبروبان ، والبيوتان ، إلخ.
على سبيل المثال ، الميثان - CH 4. هذا المزيج من الهيدروجين والكربون الظروف الطبيعيةفي حالة تجمع غازي. عندما يظهر الأكسجين في التركيبة ، يتم تكوين سائل - كحول الميثيل CH 3 OH.
لا تظهر فقط المواد ذات التركيب النوعي المختلف (كما في المثال أعلاه) خصائص مختلفة ، ولكن المواد التي لها نفس التركيب النوعي قادرة أيضًا على ذلك. مثال على ذلك هو القدرة المختلفة للميثان CH 4 والإيثيلين C 2 H 4 على التفاعل مع البروم والكلور. الميثان قادر على حدوث مثل هذه التفاعلات فقط عند تسخينه أو تحت الضوء فوق البنفسجي. ويتفاعل الإيثيلين حتى بدون إضاءة وتسخين.
ضع في اعتبارك هذا الخيار: التركيب النوعي للمركبات الكيميائية هو نفسه ، والكمي مختلف. ثم تختلف الخصائص الكيميائية للمركبات. كما في حالة الأسيتيلين C 2 H 2 والبنزين C 6 H 6.
لا يلعب الدور الأخير في هذا التنوع خصائص المواد العضوية "المرتبطة" ببنيتها ، مثل التماثل والتماثل.
تخيل أن لديك مادتين متطابقتين على ما يبدو - نفس التركيب ونفس الصيغة الجزيئية لوصفهما. لكن بنية هذه المواد تختلف اختلافًا جوهريًا ، والتي تتبع الاختلاف في المواد الكيميائية و الخصائص الفيزيائية. على سبيل المثال ، الصيغة الجزيئيةمع 4 H 10 يمكنك كتابة اثنين مواد مختلفة: البيوتان والأيزوبيوتان.

نحن نتحدث عن نظائر- المركبات التي لها نفس التركيب والوزن الجزيئي. لكن الذرات في جزيئاتها تقع في ترتيب مختلف (بنية متفرعة وغير متفرعة).
بخصوص تناددهي سمة من سمات سلسلة الكربون التي فيها كل المسطلح التالييمكن الحصول عليها بإضافة مجموعة CH 2 إلى المجموعة السابقة. يمكن التعبير عن كل سلسلة متماثلة بصيغة عامة واحدة. ومعرفة الصيغة ، من السهل تحديد تركيبة أي من أعضاء السلسلة. على سبيل المثال ، يتم وصف متماثلات الميثان بالصيغة C n H 2n + 2.
عند إضافة "الاختلاف المتماثل" CH 2 ، يتم تقوية الرابطة بين ذرات المادة. لنأخذ السلسلة المتجانسة من الميثان: أول أربعة أعضائها عبارة عن غازات (الميثان ، الإيثان ، البروبان ، البيوتان) ، الستة التالية هي السوائل (البنتان ، الهكسان ، الهبتان ، الأوكتان ، النونان ، الديكان) ، ثم المواد في الحالة الصلبة من التجميع التالي (البنتاديكان ، الإيكوسان ، إلخ). وكلما كانت الرابطة أقوى بين ذرات الكربون ، زاد الوزن الجزيئي ونقاط غليان وانصهار المواد.
ما هي فئات المواد العضوية الموجودة؟
المواد العضوية ذات الأصل البيولوجي تشمل:
- البروتينات.
- الكربوهيدرات.
- احماض نووية؛
- الدهون.
يمكن أيضًا تسمية النقاط الثلاث الأولى بالبوليمرات البيولوجية.
أكثر تصنيف مفصلالمواد الكيميائية العضوية تغطي المواد ليس فقط من أصل بيولوجي.
الهيدروكربونات هي:
- مركبات لا حلقية:
- الهيدروكربونات المشبعة (الألكانات) ؛
- الهيدروكربونات غير المشبعة:
- الألكينات.
- ألكينات.
- الكاديين.
- المركبات الحلقية:
- المركبات الكربوهيدراتية الحلقية:
- أليكسليك.
- عطري.
- المركبات الحلقية غير المتجانسة.
- المركبات الكربوهيدراتية الحلقية:
هناك أيضًا فئات أخرى من المركبات العضوية التي يتحد فيها الكربون مع مواد أخرى غير الهيدروجين:
- الكحولات والفينولات.
- الألدهيدات والكيتونات.
- الأحماض الكربوكسيلية؛
- استرات.
- الدهون.
- الكربوهيدرات:
- السكريات الأحادية.
- قليل السكاريد.
- السكريات.
- عديدات السكاريد المخاطية.
- الأمينات.
- أحماض أمينية؛
- البروتينات.
- احماض نووية.
صيغ المواد العضوية حسب الفئات

أمثلة على المواد العضوية
كما تتذكر ، في جسم الانسان أنواع مختلفةالمواد العضوية هي أساس الأسس. هذه هي الأنسجة والسوائل ، والهرمونات والأصباغ ، والإنزيمات و ATP ، وأكثر من ذلك بكثير.
في أجسام البشر والحيوانات ، يتم إعطاء الأولوية للبروتينات والدهون (نصف الوزن الجاف للخلية الحيوانية هو البروتين). في النباتات (حوالي 80٪ من الكتلة الجافة للخلية) - للكربوهيدرات ، المعقدة في المقام الأول - السكريات. بما في ذلك السليلوز (الذي بدونه لن يكون هناك ورق) ، النشا.
دعنا نتحدث عن بعضها بمزيد من التفصيل.
على سبيل المثال ، حول الكربوهيدرات. إذا كان من الممكن قياس كتل جميع المواد العضوية على هذا الكوكب وقياسها ، فستكون الكربوهيدرات هي التي ستفوز بهذه المنافسة.
هم بمثابة مصدر للطاقة في الجسم مواد بناءللخلايا ، وكذلك القيام بتوريد المواد. تستخدم النباتات النشا لهذا الغرض ، والجليكوجين للحيوانات.
بالإضافة إلى ذلك ، فإن الكربوهيدرات متنوعة للغاية. على سبيل المثال، الكربوهيدرات البسيطة. السكريات الأحادية الأكثر شيوعًا في الطبيعة هي البنتوز (بما في ذلك الديوكسيريبوز ، وهو جزء من الحمض النووي) والسداسي (الجلوكوز ، وهو معروف جيدًا بالنسبة لك).
مثل الطوب ، في موقع بناء كبير من الطبيعة ، يتم بناء السكريات من آلاف وآلاف من السكريات الأحادية. بدونهم ، بتعبير أدق ، بدون السليلوز ، النشا ، لن تكون هناك نباتات. نعم ، وستواجه الحيوانات التي لا تحتوي على الجليكوجين واللاكتوز والكيتين وقتًا عصيبًا.
دعونا ننظر بعناية في السناجب. الطبيعة هي أعظم سيد للفسيفساء والألغاز: من 20 فقط من الأحماض الأمينية ، يتكون جسم الإنسان من 5 ملايين نوع من البروتينات. الكثير من الحيوية تكمن في البروتينات أيضًا. وظائف مهمة. على سبيل المثال ، البناء ، وتنظيم العمليات في الجسم ، وتخثر الدم (هناك بروتينات منفصلة لهذا) ، والحركة ، ونقل بعض المواد في الجسم ، كما أنها مصدر للطاقة ، في شكل إنزيمات تعمل بمثابة محفز للتفاعلات ، يوفر الحماية. في حماية الجسم من السلبيات تأثيرات خارجيةتلعب الأجسام المضادة دورًا مهمًا. وإذا كان في الكون المثالىالجسم في حالة خلاف ، يمكن للأجسام المضادة ، بدلاً من تدمير الأعداء الخارجيين ، أن تعمل كمعتدين على أعضائها وأنسجة الجسم.

تنقسم البروتينات أيضًا إلى بسيطة (بروتينات) ومعقدة (بروتينات). ولديهم خصائص ملازمة لهم فقط: التمسخ (التدمير الذي لاحظته أكثر من مرة عند سلق بيضة مسلوقة جيدًا) وإعادة التشبع (تم العثور على هذه الخاصية تطبيق واسعفي صناعة المضادات الحيوية ، مركزات الأغذية ، إلخ).
دعونا لا نتجاهل و الدهون(دهون). في أجسامنا ، هم بمثابة مصدر احتياطي للطاقة. كمذيبات ، فهي تساعد في مسار التفاعلات الكيميائية الحيوية. المشاركة في بناء الجسم - على سبيل المثال ، في تكوين أغشية الخلايا.
وبضع كلمات أخرى حول المركبات العضوية الغريبة مثل الهرمونات. يشاركون في التفاعلات الكيميائية الحيوية والتمثيل الغذائي. هذه الهرمونات الصغيرة تصنع الرجال (هرمون التستوستيرون) والنساء (هرمون الاستروجين). اجعلنا سعداء أو حزينين (تلعب الهرمونات دورًا مهمًا في تقلبات المزاج) الغدة الدرقيةوالإندورفين يعطي شعوراً بالسعادة). بل إنهم يقررون ما إذا كنا "بووم" أو "قبرات". هل أنت مستعد للدراسة متأخرًا أم تفضل الاستيقاظ مبكرًا والقيام بذلك العمل في المنزلقبل المدرسة ، يقرر ليس فقط روتينك اليومي ، ولكن أيضًا بعض هرمونات الغدة الكظرية.
خاتمة
إن عالم المواد العضوية مدهش حقًا. يكفي الخوض في دراستها قليلاً لتأخذ أنفاسك بعيدًا عن الشعور بالقرابة مع كل أشكال الحياة على الأرض. ساقان أو أربع أو جذور بدلاً من الأرجل - نحن جميعًا متحدون بسحر المختبر الكيميائي للطبيعة الأم. إنه يتسبب في انضمام ذرات الكربون في سلاسل ، والتفاعل وإنشاء الآلاف من هذه المركبات الكيميائية المتنوعة.
لديك الآن دليل موجز للكيمياء العضوية. بالطبع ، ليست كل المعلومات الممكنة معروضة هنا. بعض النقاط قد تضطر إلى توضيحها بنفسك. ولكن يمكنك دائمًا استخدام المسار الذي خططنا له لبحثك المستقل.
يمكنك أيضًا استخدام تعريف المادة العضوية الوارد في المقالة ، والتصنيف والصيغ العامة للمركبات العضوية و معلومات عامةعنهم للتحضير لدروس الكيمياء في المدرسة.
أخبرنا في التعليقات عن قسم الكيمياء (عضوي أو غير عضوي) الذي تفضله ولماذا. لا تنسى مشاركة المقال في الشبكات الاجتماعيةحتى يمكن لزملائك في الفصل استخدامها أيضًا.
يرجى الإبلاغ إذا وجدت أي خطأ أو عدم دقة في المقالة. كلنا بشر وكلنا نرتكب أخطاء في بعض الأحيان.
الموقع ، مع النسخ الكامل أو الجزئي للمادة ، يلزم وجود رابط إلى المصدر.








