DEFINITION
Uranus- zweiundneunzigstes Element Periodensystem. Bezeichnung - U aus dem lateinischen "Uran". Befindet sich in der siebten Periode, Gruppe IIIB. Bezieht sich auf Metalle. Die Kernladung beträgt 92.
Uran ist ein silbriges Metall mit glänzender Oberfläche (Abb. 1). Schwer. Formbar, flexibel und weich. Die Eigenschaften von Paramagneten sind inhärent. Uran ist durch das Vorhandensein von drei Modifikationen gekennzeichnet: α-Uran (rhombisches System), β-Uran (tetragonales System) und γ-Uran (kubisches System), die jeweils in einem bestimmten Temperaturbereich existieren.
Reis. 1. Uranos. Aussehen.
Atom- und Molekulargewicht von Uran
Relatives Molekulargewicht einer Substanz(M r) ist eine Zahl, die angibt, wie oft die Masse eines bestimmten Moleküls größer als 1/12 der Masse eines Kohlenstoffatoms ist, und relative Atommasse eines Elements(A r) - wie oft die durchschnittliche Atommasse eines chemischen Elements größer als 1/12 der Masse eines Kohlenstoffatoms ist.
Da Uran im freien Zustand in Form von einatomigen U-Molekülen vorliegt, sind die Werte seiner atomaren und molekularen Masse gleich. Sie sind gleich 238,0289.
Isotope von Uran
Es ist bekannt, dass Uran keine stabilen Isotope hat, aber natürliches Uran besteht aus einer Mischung der radioaktiven Isotope 238 U (99,27 %), 235 U und 234 U.
Es gibt instabile Uranisotope mit Massenzahlen von 217 bis 242.
Uran-Ionen
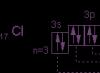
Auf der äußeren Energieebene des Uranatoms gibt es drei Valenzelektronen:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 5f 3 6s 2 6p 6 6d 1 7s 2 .
Durch chemische Wechselwirkung gibt Uran seine Valenzelektronen ab, d.h. ist ihr Spender und verwandelt sich in ein positiv geladenes Ion:
U 0 -3e → U 3+.
Molekül und Atom von Uran
Im freien Zustand liegt Uran in Form von einatomigen Molekülen U vor. Hier sind einige Eigenschaften, die das Atom und Molekül von Uran charakterisieren:
Beispiele für Problemlösungen
BEISPIEL 1
BEISPIEL 2
| Übung | In der Reihe der radioaktiven Umwandlung von Uran gibt es folgende Stufen: 238 92 U → 234 90 Th → 234 91 Pa → X. Welche Partikel werden in den ersten beiden Stufen emittiert? Welches Isotop X entsteht im dritten Stadium, wenn es mit der Emission eines β-Teilchens einhergeht? |
| Antworten | Wir bestimmen, wie sich die Massenzahl und Ladung des Radionuklidkerns in der ersten Stufe ändern. Die Massenzahl nimmt um 4 Einheiten ab und die Ladungszahl um 2 Einheiten, daher tritt in der ersten Stufe ein α-Zerfall auf. Wir bestimmen, wie sich Massenzahl und Ladung des Radionuklidkerns in der zweiten Stufe ändern. Die Massenzahl ändert sich nicht, und die Ladung des Kerns steigt um eins, was auf einen β-Zerfall hinweist. |
Woher kam Uran? Höchstwahrscheinlich tritt es während Supernova-Explosionen auf. Tatsache ist, dass für die Nukleosynthese von Elementen, die schwerer als Eisen sind, ein starker Neutronenfluss vorhanden sein muss, der gerade während einer Supernova-Explosion auftritt. Es scheint, dass Uran, das sich in einer protoplanetaren Wolke gesammelt hat und sehr schwer ist, später, wenn es aus der Wolke neuer Sternensysteme kondensiert, in die Tiefen der Planeten sinken sollte. Aber das ist nicht so. Uran ist ein radioaktives Element und setzt beim Zerfall Wärme frei. Die Berechnung zeigt, dass Uran, wenn es gleichmäßig über die gesamte Dicke des Planeten verteilt wäre, zumindest in der gleichen Konzentration wie an der Oberfläche, zu viel Wärme abgeben würde. Darüber hinaus sollte sein Durchfluss abnehmen, wenn Uran verbraucht wird. Da nichts dergleichen beobachtet wird, glauben Geologen, dass mindestens ein Drittel des Urans, vielleicht sogar alles, in der Erdkruste konzentriert ist, wo sein Gehalt 2,5∙10 -4 % beträgt. Warum dies geschah, wird nicht diskutiert.
Wo wird Uran abgebaut? Uran auf der Erde ist nicht so klein - in Bezug auf die Prävalenz liegt es auf Platz 38. Und vor allem ist dieses Element in Sedimentgesteinen - kohligen Schiefern und Phosphoriten: bis zu 8∙10 -3 bzw. 2,5∙10 -2%. Insgesamt enthält die Erdkruste 10 14 Tonnen Uran, aber das Hauptproblem besteht darin, dass es sehr verteilt ist und keine mächtigen Ablagerungen bildet. Etwa 15 Uranminerale sind von industrieller Bedeutung. Dies ist Uranharz - seine Basis ist vierwertiges Uranoxid, Uranglimmer - verschiedene Silikate, Phosphate und mehr komplexe Zusammenhänge mit Vanadium oder Titan auf Basis von sechswertigem Uran.
Was sind Becquerelstrahlen? Nach der Entdeckung der Röntgenstrahlen durch Wolfgang Röntgen interessierte sich der französische Physiker Antoine-Henri Becquerel für das Leuchten von Uransalzen, das unter Einwirkung von Sonnenlicht entsteht. Er wollte verstehen, ob es hier auch Röntgenbilder gab. Tatsächlich waren sie anwesend – das Salz beleuchtete die Fotoplatte durch das schwarze Papier. In einem der Experimente wurde das Salz jedoch nicht beleuchtet, und die fotografische Platte verdunkelte sich noch immer. Wenn ein Metallgegenstand zwischen das Salz und die fotografische Platte gelegt wurde, war die Verdunkelung darunter geringer. Folglich sind die neuen Strahlen durch die Anregung von Uran durch Licht überhaupt nicht entstanden und haben das Metall nicht teilweise durchdrungen. Sie wurden zunächst "Becquerelstrahlen" genannt. Anschließend wurde festgestellt, dass dies hauptsächlich Alphastrahlen mit einem geringen Zusatz von Betastrahlen sind: Tatsache ist, dass die Hauptisotope von Uran während des Zerfalls ein Alphateilchen emittieren und die Tochterprodukte ebenfalls einen Betazerfall erfahren.
Wie hoch ist die Radioaktivität von Uran? Uran hat keine stabilen Isotope, sie sind alle radioaktiv. Das langlebigste ist Uran-238 mit einer Halbwertszeit von 4,4 Milliarden Jahren. Das nächste ist Uran-235 - 0,7 Milliarden Jahre. Beide durchlaufen einen Alpha-Zerfall und werden zu den entsprechenden Isotopen von Thorium. Uran-238 macht über 99 % des gesamten natürlichen Urans aus. Aufgrund seiner langen Halbwertszeit ist die Radioaktivität dieses Elements gering, und außerdem können Alphateilchen die Hornschicht auf der Oberfläche des menschlichen Körpers nicht überwinden. Sie sagen, dass IV Kurchatov, nachdem er mit Uran gearbeitet hatte, seine Hände einfach mit einem Taschentuch abgewischt hatte und nicht an Krankheiten litt, die mit Radioaktivität verbunden waren.
Forscher haben sich wiederholt der Statistik von Krankheiten von Arbeitern in Uranminen und -verarbeitungsanlagen zugewandt. Hier ist zum Beispiel ein kürzlich erschienener Artikel kanadischer und amerikanischer Experten, die die Gesundheitsdaten von mehr als 17.000 Arbeitern der Eldorado-Mine in der kanadischen Provinz Saskatchewan für die Jahre 1950-1999 analysiert haben ( Umweltforschung, 2014, 130, 43–50, DOI:10.1016/j.envres.2014.01.002). Sie gingen davon aus, dass Strahlung am stärksten auf sich schnell vermehrende Blutzellen einwirkt und zu den entsprechenden Krebsarten führt. Statistiken zeigten auch, dass Minenarbeiter eine geringere Inzidenz verschiedener Arten von Blutkrebs haben als der durchschnittliche Kanadier. Als Hauptstrahlungsquelle gilt dabei nicht das Uran selbst, sondern das von ihm erzeugte gasförmige Radon und seine Zerfallsprodukte, die über die Lunge in den Körper gelangen können.
Warum ist Uran schädlich?? Es ist wie andere Schwermetalle hochgiftig und kann Nieren- und Leberversagen. Andererseits ist Uran als dispergiertes Element unvermeidlich in Wasser und Boden vorhanden und gelangt über die Nahrungskette in den menschlichen Körper. Es ist anzunehmen, dass Lebewesen im Laufe der Evolution gelernt haben, Uran in natürlichen Konzentrationen zu neutralisieren. Das gefährlichste Uran befindet sich im Wasser, daher legte die WHO einen Grenzwert fest: Zunächst waren es 15 µg/l, doch 2011 wurde der Standard auf 30 µg/g erhöht. In der Regel ist viel weniger Uran im Wasser: in den USA durchschnittlich 6,7 μg / l, in China und Frankreich - 2,2 μg / l. Aber es gibt auch starke Abweichungen. In einigen Gebieten Kaliforniens ist es also hundertmal höher als der Standard - 2,5 mg / l, und in Südfinnland erreicht es 7,8 mg / l. Forscher versuchen zu verstehen, ob der WHO-Standard zu streng ist, indem sie die Wirkung von Uran auf Tiere untersuchen. Hier ist ein typischer Job BioMed Research International, 2014, ID 181989; DOI:10.1155/2014/181989). Französische Wissenschaftler fütterten Ratten neun Monate lang mit Wasser, das mit abgereichertem Uran angereichert war, und zwar in einer relativ hohen Konzentration - von 0,2 bis 120 mg / l. Der untere Wert ist Wasser in der Nähe der Mine, während der obere nirgendwo zu finden ist - die maximale Urankonzentration, gemessen im selben Finnland, beträgt 20 mg / l. Zur Überraschung der Autoren - der Artikel trägt den Titel: "Das unerwartete Fehlen einer merklichen Wirkung von Uran auf physiologische Systeme ..." - hatte Uran praktisch keine Auswirkungen auf die Gesundheit von Ratten. Die Tiere fraßen gut, nahmen ordentlich zu, klagten nicht über Krankheiten und starben nicht an Krebs. Uran wurde, wie es sein sollte, hauptsächlich in den Nieren und Knochen und in hundertfach geringerer Menge in der Leber abgelagert, und seine Ansammlung hing erwartungsgemäß vom Wassergehalt ab. Dies führte jedoch nicht zu einem Nierenversagen oder gar zum auffälligen Auftreten molekularer Entzündungsmarker. Die Autoren schlugen vor, mit einer Überprüfung der strengen WHO-Richtlinien zu beginnen. Allerdings gibt es eine Einschränkung: die Wirkung auf das Gehirn. In den Gehirnen von Ratten war weniger Uran als in der Leber, aber sein Gehalt hing nicht von der Wassermenge ab. Aber Uran beeinflusste die Arbeit des antioxidativen Systems des Gehirns: Die Aktivität der Katalase stieg um 20 %, die Glutathionperoxidase um 68–90 %, während die Aktivität der Superoxiddismutase unabhängig von der Dosis um 50 % abfiel. Das bedeutet, dass Uran eindeutig oxidativen Stress im Gehirn verursacht hat und der Körper darauf reagiert hat. Eine solche Wirkung - übrigens eine starke Wirkung von Uran auf das Gehirn ohne Ansammlung darin sowie in den Geschlechtsorganen - wurde früher bemerkt. Außerdem Wasser mit Uran in einer Konzentration von 75–150 mg/l, das Forscher der University of Nebraska sechs Monate lang an Ratten verfütterten ( Neurotoxikologie und Teratologie, 2005, 27, 1, 135–144; DOI:10.1016/j.ntt.2004.09.001) beeinflusste das Verhalten von Tieren, hauptsächlich Männchen, die ins Feld entlassen wurden: Sie überquerten die Linien, stellten sich auf ihre Hinterbeine und bürsteten ihr Fell, im Gegensatz zu den Kontrolltieren. Es gibt Hinweise darauf, dass Uran auch bei Tieren zu Gedächtnisstörungen führt. Die Verhaltensänderung korrelierte mit dem Grad der Lipidoxidation im Gehirn. Es stellt sich heraus, dass Ratten aus Uranwasser gesund, aber dumm wurden. Diese Daten werden uns weiterhin bei der Analyse des sogenannten Persischen-Golf-Syndroms (Golfkriegssyndrom) nützlich sein.
Verschmutzt Uran Schiefergasabbaustätten? Es hängt davon ab, wie viel Uran sich in den gashaltigen Gesteinen befindet und wie es mit ihnen verbunden ist. Beispielsweise hat Associate Professor Tracy Bank von der University at Buffalo den Marcelus Shale erkundet, der sich vom westlichen Bundesstaat New York über Pennsylvania und Ohio bis nach West Virginia erstreckt. Es stellte sich heraus, dass Uran genau mit der Kohlenwasserstoffquelle chemisch gebunden ist (erinnern Sie sich daran, dass verwandte kohlenstoffhaltige Schiefer den höchsten Urangehalt aufweisen). Experimente haben gezeigt, dass die zum Brechen des Flözes verwendete Lösung Uran perfekt auflöst. „Wenn das Uran in diesen Gewässern an der Oberfläche ist, kann es die Umgebung verschmutzen. Es birgt kein Strahlenrisiko, aber Uran ist ein giftiges Element“, stellt Tracey Bank in einer Pressemitteilung der Universität vom 25. Oktober 2010 fest. Ausführliche Artikel zum Risiko einer Umweltverschmutzung mit Uran oder Thorium bei der Förderung von Schiefergas wurden noch nicht erstellt.
Warum wird Uran benötigt? Früher wurde es als Pigment für die Herstellung von Keramik und farbigem Glas verwendet. Jetzt ist Uran die Grundlage der Kernenergie und der Kernwaffen. Dabei verwendet es einzigartiges Eigentum- die Teilungsfähigkeit des Zellkerns.
Was ist Kernspaltung? Der Zerfall des Zellkerns in zwei ungleich große Stücke. Gerade wegen dieser Eigenschaft entstehen bei der Nukleosynthese durch Neutronenbestrahlung nur sehr schwer Kerne, die schwerer als Uran sind. Die Essenz des Phänomens ist wie folgt. Wenn das Verhältnis der Anzahl von Neutronen und Protonen im Kern nicht optimal ist, wird er instabil. Normalerweise stößt ein solcher Kern entweder ein Alpha-Teilchen aus - zwei Protonen und zwei Neutronen, oder ein Beta-Teilchen - ein Positron, das von der Umwandlung eines der Neutronen in ein Proton begleitet wird. Im ersten Fall wird ein Element des Periodensystems erhalten, das zwei Zellen nach hinten beabstandet ist, im zweiten - eine Zelle nach vorne. Der Urankern kann jedoch nicht nur Alpha- und Beta-Teilchen emittieren, sondern auch spalten - in die Kerne von zwei Elementen in der Mitte des Periodensystems wie Barium und Krypton zerfallen, was er tut, nachdem er ein neues Neutron erhalten hat . Dieses Phänomen wurde kurz nach der Entdeckung der Radioaktivität entdeckt, als Physiker alles, was sie hatten, der neu entdeckten Strahlung aussetzten. So schreibt Otto Frisch, Teilnehmer der Veranstaltungen, darüber („Erfolge Physikalische Wissenschaften “, 1968, 96, 4). Nach der Entdeckung der Berylliumstrahlen – Neutronen – bestrahlte Enrico Fermi sie, insbesondere Uran, um den Beta-Zerfall zu verursachen – er hoffte, das nächste, 93. Element, jetzt Neptunium genannt, auf seine Kosten zu bekommen. Er war es, der eine neue Art von Radioaktivität in bestrahltem Uran entdeckte, die er mit dem Auftreten von Transuran-Elementen in Verbindung brachte. In diesem Fall verstärkte das Abbremsen von Neutronen, für die die Berylliumquelle mit einer Paraffinschicht bedeckt war, diese induzierte Radioaktivität. Der amerikanische Radiochemiker Aristide von Grosse schlug vor, eines dieser Elemente sei Protactinium, aber er irrte sich. Aber Otto Hahn, der damals an der Universität Wien arbeitete und das 1917 entdeckte Protactinium für seine Idee hielt, entschied, dass er herausfinden musste, welche Elemente in diesem Fall erhalten wurden. Zusammen mit Lise Meitner schlug Hahn Anfang 1938 auf der Grundlage von Experimenten vor, dass ganze Ketten radioaktiver Elemente gebildet werden, die aus mehreren Beta-Zerfällen der Kerne von Uran-238 entstehen, die das Neutron und seine Tochterelemente absorbierten. Bald musste Lise Meitner aus Angst vor möglichen Repressalien der Nazis nach dem Anschluss Österreichs nach Schweden fliehen. Gan, der seine Experimente mit Fritz Strassmann fortsetzte, entdeckte, dass sich unter den Produkten auch Barium befand, Elementnummer 56, das auf keine Weise aus Uran hätte gewonnen werden können: Alle Ketten von Uran-Alpha-Zerfällen enden in viel schwererem Blei. Die Forscher waren von dem Ergebnis so überrascht, dass sie es nicht veröffentlichten, sondern nur Briefe an Freunde schrieben, insbesondere an Lise Meitner in Göteborg. Dort besuchte sie Weihnachten 1938 ihr Neffe Otto Frisch, und bei einem Spaziergang in der Nähe der Winterstadt - er auf Skiern, seine Tante zu Fuß - diskutierten sie über die Möglichkeit des Auftretens von Barium bei der Bestrahlung Uran durch Kernspaltung (zu Lise Meitner siehe „Chemie und Leben“, 2013, Nr. 4). Als Frisch nach Kopenhagen zurückkehrte, erwischte Frisch, buchstäblich auf der Gangway eines Dampfers, der in die USA abfuhr, Niels Bohr und informierte ihn über die Idee der Teilung. Bor schlug sich auf die Stirn und sagte: „Oh, was waren wir für Dummköpfe! Das hätten wir früher merken müssen." Im Januar 1939 veröffentlichten Frisch und Meitner einen Artikel über die Spaltung von Urankernen unter Einwirkung von Neutronen. Zu diesem Zeitpunkt hatte Otto Frisch bereits ein Kontrollexperiment eingerichtet, ebenso wie viele amerikanische Gruppen, die eine Nachricht von Bohr erhielten. Sie sagen, dass die Physiker direkt während seines Berichts am 26. Januar 1939 in Washington auf der Jahreskonferenz für theoretische Physik begannen, sich in ihre Labors zu zerstreuen, als sie die Essenz der Idee erfassten. Nach der Entdeckung der Kernspaltung überarbeiteten Hahn und Strassmann ihre Experimente und stellten ebenso wie ihre Kollegen fest, dass die Radioaktivität von bestrahltem Uran nicht mit Transuranen zusammenhängt, sondern mit dem Zerfall radioaktiver Elemente, die bei der Kernspaltung aus der Mitte des Periodensystems entstehen.
Wie funktioniert eine Kettenreaktion in Uran? Kurz nachdem die Möglichkeit der Spaltung von Uran- und Thoriumkernen experimentell nachgewiesen wurde (und es gibt keine anderen spaltbaren Elemente auf der Erde in nennenswerten Mengen), Niels Bohr und John Wheeler, die in Princeton arbeiteten, sowie unabhängig voneinander der sowjetische theoretische Physiker Ya I. Frenkel und die Deutschen Siegfried Flügge und Gottfried von Droste schufen die Theorie der Kernspaltung. Daraus folgten zwei Mechanismen. Einer hängt mit der Schwellenabsorption schneller Neutronen zusammen. Ihm zufolge muss das Neutron, um die Spaltung einzuleiten, eine ziemlich hohe Energie haben, mehr als 1 MeV für die Kerne der Hauptisotope - Uran-238 und Thorium-232. Bei niedrigeren Energien hat die Absorption eines Neutrons durch Uran-238 einen resonanten Charakter. So hat ein Neutron mit einer Energie von 25 eV einen tausendfach größeren Einfangquerschnitt als bei anderen Energien. In diesem Fall findet keine Spaltung statt: Uran-238 wird zu Uran-239, das mit einer Halbwertszeit von 23,54 Minuten zu Neptunium-239 wird, das mit einer Halbwertszeit von 2,33 Tagen wird zu Long- lebte Plutonium-239. Aus Thorium-232 wird Uran-233.
Der zweite Mechanismus ist die schwellenlose Absorption eines Neutrons, gefolgt vom dritten mehr oder weniger verbreiteten spaltbaren Isotop - Uran-235 (sowie Plutonium-239 und Uran-233, die in der Natur nicht vorkommen): durch die Absorption von Neutronen , selbst ein langsamer, der sogenannte thermische, mit einer Energie von 0,025 eV für Moleküle, die an der thermischen Bewegung teilnehmen, wird ein solcher Kern geteilt. Und das ist sehr gut: Bei thermischen Neutronen ist die Einfangquerschnittsfläche viermal größer als bei schnellen Megaelektronenvolt-Neutronen. Darin liegt die Bedeutung von Uran-235 für die gesamte weitere Geschichte der Kernenergie: Es sorgt für die Vervielfältigung der Neutronen im natürlichen Uran. Nach dem Auftreffen auf ein Neutron wird der Uran-235-Kern instabil und spaltet sich schnell in zwei ungleiche Teile. Unterwegs fliegen mehrere (durchschnittlich 2,75) neue Neutronen aus. Wenn sie auf die Kerne desselben Urans treffen, vermehren sich die Neutronen exponentiell - eine Kettenreaktion beginnt, die aufgrund der schnellen Freisetzung einer großen Wärmemenge zu einer Explosion führt. Weder Uran-238 noch Thorium-232 können so funktionieren: Immerhin werden bei der Spaltung Neutronen mit einer durchschnittlichen Energie von 1-3 MeV emittiert, dh bei einer Energieschwelle von 1 MeV ein erheblicher Teil davon Neutronen werden sicherlich keine Reaktion hervorrufen können, und es wird keine Reproduktion geben. Dies bedeutet, dass diese Isotope vergessen werden sollten und Neutronen auf thermische Energie abgebremst werden müssen, damit sie so effizient wie möglich mit Uran-235-Kernen interagieren. Gleichzeitig kann ihre resonante Absorption durch Uran-238 nicht zugelassen werden: Schließlich liegt dieses Isotop in natürlichem Uran bei etwas weniger als 99,3%, und Neutronen kollidieren häufiger damit und nicht mit dem Ziel-Uran-235. Und als Moderator ist es möglich, die Neutronenvervielfachung auf einem konstanten Niveau zu halten und eine Explosion zu verhindern - um eine Kettenreaktion zu kontrollieren.
Die von Ya. B. Zeldovich und Yu. B. Khariton im selben schicksalhaften Jahr 1939 durchgeführte Berechnung zeigte, dass es dazu notwendig ist, einen Neutronenmoderator in Form von schwerem Wasser oder Graphit zu verwenden und natürliches Uran mit Uran-235 anzureichern mindestens 1,83 mal. Dann erschien ihnen diese Idee als reine Fantasie: „Es sei darauf hingewiesen, dass die ungefähr doppelte Anreicherung jener ziemlich erheblichen Mengen an Uran, die zur Durchführung einer Kettenexplosion erforderlich sind,<...>ist eine äußerst mühselige Aufgabe, praktisch praktisch unmöglich." Jetzt ist dieses Problem gelöst, und die Nuklearindustrie produziert mit Uran-235 bis zu 3,5 % angereichertes Uran in Massenproduktion für Kraftwerke.
Was ist spontane Kernspaltung? Im Jahr 1940 entdeckten G. N. Flerov und K. A. Petrzhak, dass die Uranspaltung spontan und ohne irgendwelche auftreten kann Äußerer Einfluss, obwohl die Halbwertszeit viel länger ist als die des normalen Alpha-Zerfalls. Da eine solche Spaltung auch Neutronen erzeugt, dienen sie als Initiatoren der Kettenreaktion, wenn sie nicht aus der Reaktionszone wegfliegen dürfen. Es ist dieses Phänomen, das bei der Schaffung von Kernreaktoren verwendet wird.
Warum brauchst du Atomkraft? Zel'dovich und Khariton gehörten zu den ersten, die die wirtschaftlichen Auswirkungen der Kernenergie berechneten (Uspekhi fizicheskikh nauk, 1940, 23, 4). „... Im Moment ist es noch unmöglich, endgültige Aussagen über die Möglichkeit oder Unmöglichkeit der Durchführung einer Kernspaltungsreaktion in Uran mit unendlich verzweigten Ketten zu treffen. Wenn eine solche Reaktion durchführbar ist, wird die Reaktionsgeschwindigkeit automatisch angepasst, um sicherzustellen, dass sie trotzdem glatt abläuft große Menge Energie, die dem Experimentator zur Verfügung steht. Dieser Umstand ist für die Energieausnutzung der Reaktion außerordentlich günstig. Obwohl es sich hier um eine Teilung der Haut eines ungetöteten Bären handelt, stellen wir daher einige Zahlen vor, die die Möglichkeiten der energetischen Nutzung von Uran charakterisieren. Wenn der Spaltungsprozess auf schnellen Neutronen abläuft, fängt die Reaktion also das Hauptisotop von Uran (U238) ein<исходя из соотношения теплотворных способностей и цен на уголь и уран>Die Kosten für eine Kalorie aus dem Hauptisotop Uran sind etwa 4000-mal billiger als aus Kohle (es sei denn, die Prozesse des "Verbrennens" und der Wärmeabfuhr erweisen sich im Fall von Uran als viel teurer als bei Kohle). Bei langsamen Neutronen sind die Kosten für eine "Uran"-Kalorie (basierend auf den obigen Zahlen) unter Berücksichtigung der Häufigkeit des Isotops U235 von 0,007 bereits nur 30-mal billiger als eine "Kohle"-Kalorie. alle anderen Dinge sind gleich.
Die erste kontrollierte Kettenreaktion wurde 1942 von Enrico Fermi an der University of Chicago durchgeführt, und der Reaktor wurde manuell gesteuert, indem Graphitstäbe geschoben und herausgezogen wurden, wenn sich der Neutronenfluss änderte. Das erste Kraftwerk wurde 1954 in Obninsk gebaut. Neben der Energieerzeugung dienten die ersten Reaktoren auch der Produktion von waffenfähigem Plutonium.
Wie funktioniert ein Atomkraftwerk? Die meisten Reaktoren arbeiten heute mit langsamen Neutronen. Angereichertes Uran in Form eines Metalls, einer Legierung, beispielsweise mit Aluminium, oder in Form eines Oxids wird in lange Zylinder – Brennelemente – eingebracht. Sie werden auf bestimmte Weise in den Reaktor eingebaut und zwischen ihnen Stäbe des Moderators eingeführt, die die Kettenreaktion steuern. Im Brennelement reichern sich mit der Zeit Reaktorgifte an - Uran-Spaltprodukte, die auch Neutronen absorbieren können. Wenn die Uran-235-Konzentration unter den kritischen Wert fällt, wird das Element stillgelegt. Es enthält jedoch viele Spaltfragmente mit starker Radioaktivität, die im Laufe der Jahre abnimmt, weshalb die Elemente lange emittieren. signifikante Menge Wärme. Sie werden in Kühlbecken aufbewahrt und dann entweder vergraben oder sie versuchen, sie zu verarbeiten - um unverbranntes Uran-235, angesammeltes Plutonium (es wurde zur Herstellung von Atombomben verwendet) und andere verwendbare Isotope zu extrahieren. Der unbenutzte Teil wird auf die Begräbnisstätte geschickt.
In sogenannten schnellen Neutronenreaktoren oder Brutreaktoren werden Reflektoren aus Uran-238 oder Thorium-232 um die Elemente herum installiert. Sie werden langsamer und schicken zu schnelle Neutronen zurück in die Reaktionszone. Auf Resonanzgeschwindigkeit verlangsamt, absorbieren Neutronen diese Isotope und verwandeln sich in Plutonium-239 bzw. Uran-233, das als Brennstoff für ein Kernkraftwerk dienen kann. Da schnelle Neutronen nicht gut mit Uran-235 reagieren, muss dessen Konzentration deutlich erhöht werden, was sich aber durch einen stärkeren Neutronenfluss auszahlt. Obwohl Brutreaktoren als die Zukunft der Kernenergie gelten, da sie mehr Kernbrennstoff liefern als sie verbrauchen, haben Experimente gezeigt, dass sie schwer zu kontrollieren sind. Jetzt gibt es weltweit nur noch einen solchen Reaktor - im vierten Kraftwerk des Kernkraftwerks Belojarsk.
Wie wird Kernenergie kritisiert? Wenn wir nicht über Unfälle sprechen, war der Hauptargumentationspunkt der Gegner der Kernenergie heute der Vorschlag, die Kosten des Umweltschutzes nach der Stilllegung der Anlage und beim Umgang mit Brennstoffen in die Berechnung ihrer Wirksamkeit einzubeziehen. In beiden Fällen entsteht die Aufgabe einer zuverlässigen Endlagerung radioaktiver Abfälle, und diese Kosten trägt der Staat. Es besteht die Meinung, dass ihre wirtschaftliche Attraktivität verschwinden wird, wenn sie auf die Energiekosten verschoben werden.
Auch unter den Befürwortern der Kernenergie gibt es Widerstand. Seine Vertreter verweisen auf die Einzigartigkeit von Uran-235, das keinen Ersatz hat, weil alternative Isotope, die durch thermische Neutronen spaltbar sind – Plutonium-239 und Uran-233 – aufgrund einer Halbwertszeit von Tausenden von Jahren in der Natur fehlen. Und sie werden nur als Ergebnis der Spaltung von Uran-235 erhalten. Wenn es endet, wird das Schöne verschwinden natürliche Quelle Neutronen für eine nukleare Kettenreaktion. Durch diesen Aufwand verliert die Menschheit künftig die Möglichkeit, Thorium-232 in den Energiekreislauf einzubinden, dessen Reserven um ein Vielfaches größer sind als die von Uran.
Theoretisch können Teilchenbeschleuniger verwendet werden, um einen Fluss schneller Neutronen mit Energien im Megaelektronenvoltbereich zu erhalten. Wenn wir jedoch beispielsweise über interplanetare Flüge mit einem Atommotor sprechen, wird es sehr schwierig sein, ein Schema mit einem sperrigen Beschleuniger umzusetzen. Die Erschöpfung von Uran-235 setzt solchen Projekten ein Ende.
Was ist waffenfähiges Uran? Das ist hochangereichertes Uran-235. Seine kritische Masse – sie entspricht der Größe eines Materiestücks, in dem spontan eine Kettenreaktion abläuft – ist klein genug, um eine Munition herzustellen. Dieses Uran kann zur Herstellung einer Atombombe sowie als Zündschnur für eine thermonukleare Bombe verwendet werden.
Welche Katastrophen sind mit der Verwendung von Uran verbunden? Die in den Kernen spaltbarer Elemente gespeicherte Energie ist enorm. Durch ein Versehen oder vorsätzlich aus der Kontrolle geraten, kann diese Energie viel Ärger anrichten. Die beiden schlimmsten Atomkatastrophen ereigneten sich am 6. und 8. August 1945, als die US-Luftwaffe Atombomben auf Hiroshima und Nagasaki abwarf und Hunderttausende Zivilisten tötete und verletzte. Katastrophen kleineren Ausmaßes gehen mit Unfällen einher Atomkraftwerke und Unternehmen des Kernkreislaufs. Der erste größere Unfall ereignete sich 1949 in der UdSSR im Mayak-Werk in der Nähe von Tscheljabinsk, wo Plutonium hergestellt wurde; flüssige radioaktive Abfälle gelangten in den Fluss Techa. Im September 1957 ereignete sich darauf eine Explosion, bei der eine große Menge radioaktiven Materials freigesetzt wurde. Elf Tage später brannte der britische Plutoniumreaktor in Windscale ab, eine Wolke aus Explosionsprodukten breitete sich über Westeuropa aus. 1979 brannte der Reaktor des Kernkraftwerks Trimail Island in Pennsylvania ab. Die Unfälle im Kernkraftwerk Tschernobyl (1986) und im Kernkraftwerk Fukushima (2011) führten zu weitreichenden Folgen, als Millionen von Menschen radioaktiver Strahlung ausgesetzt waren. Die ersten verschmutzten weite Ländereien und warf 8 Tonnen Uranbrennstoff mit Zerfallsprodukten als Folge der Explosion aus, die sich über ganz Europa ausbreitete. Der zweite verschmutzte und verschmutzt drei Jahre nach dem Unfall weiterhin das Wassergebiet Pazifik See in Fischereigebieten. Die Beseitigung der Folgen dieser Unfälle war sehr teuer, und wenn diese Kosten in die Stromkosten zerlegt würden, würden sie erheblich steigen.
Ein separates Thema sind die Folgen für die menschliche Gesundheit. Laut offiziellen Statistiken profitierten viele Menschen, die die Bombardierung überlebten oder in kontaminierten Gebieten lebten, von der Exposition – erstere haben eine höhere Lebenserwartung, letztere eine geringere onkologische Erkrankungen, und Experten führen einen gewissen Anstieg der Sterblichkeit auf sozialen Stress zurück. Die Zahl der Menschen, die gerade an den Folgen von Unfällen oder infolge ihrer Liquidation starben, wird auf Hunderte von Menschen geschätzt. Atomkraftwerksgegner weisen darauf hin, dass Unfälle auf dem europäischen Kontinent zu mehreren Millionen vorzeitigen Todesfällen geführt haben, sie seien vor dem statistischen Hintergrund schlichtweg unsichtbar.
Der Entzug von Land aus der menschlichen Nutzung in Unfallzonen führt zu einem interessanten Ergebnis: Sie werden zu einer Art Reservat, in dem die Biodiversität wächst. Es stimmt, einige Tiere leiden an Krankheiten, die mit Strahlung verbunden sind. Die Frage ist, wie schnell sie sich anpassen werden erhöhten Hintergrund, bleibt offen. Es gibt auch die Meinung, dass die Folge einer chronischen Bestrahlung „Selektion für einen Narren“ ist (siehe Chemistry and Life, 2010, Nr. 5): primitivere Organismen überleben sogar im embryonalen Stadium. Insbesondere in Bezug auf Menschen dürfte dies kurz nach dem Unfall zu einer Beeinträchtigung der geistigen Fähigkeiten der in den kontaminierten Gebieten geborenen Generation führen.
Was ist abgereichertes Uran? Dies ist Uran-238, das bei der Gewinnung von Uran-235 übrig bleibt. Die Abfallmengen aus der Produktion von waffenfähigem Uran und Brennelementen sind groß – allein in den Vereinigten Staaten haben sich 600.000 Tonnen solchen Uranhexafluorids angesammelt (zu Problemen damit siehe „Chemistry and Life“, 2008, No. 5). Der Gehalt an Uran-235 beträgt 0,2%. Diese Abfälle müssen entweder bis zu besseren Zeiten gelagert werden, wenn schnelle Neutronenreaktoren gebaut werden und es möglich sein wird, Uran-238 zu Plutonium zu verarbeiten, oder irgendwie verwendet werden.
Sie fanden eine Verwendung dafür. Uran wird wie andere Übergangselemente als Katalysator verwendet. Zum Beispiel die Autoren eines Artikels in ACS-Nano vom 30. Juni 2014 schreiben sie, dass ein Uran- oder Thorium-Katalysator mit Graphen zur Reduktion von Sauerstoff und Wasserstoffperoxid „ein großes Potenzial für Energieanwendungen hat“. Aufgrund seiner hohen Dichte dient Uran als Ballast für Schiffe und als Gegengewicht für Flugzeuge. Dieses Metall eignet sich auch für den Strahlenschutz in medizinischen Geräten mit Strahlungsquellen.
Welche Waffen können aus abgereichertem Uran hergestellt werden? Kugeln und Kerne für panzerbrechende Geschosse. Hier ist die Berechnung. Je schwerer das Projektil ist, desto höher ist seine kinetische Energie. Aber je größer das Projektil, desto weniger konzentriert ist seine Wirkung. Das bedeutet, dass Schwermetalle mit hoher Dichte benötigt werden. Kugeln bestehen aus Blei (Ural-Jäger verwendeten einst auch natives Platin, bis sie erkannten, dass es sich um ein Edelmetall handelte), während die Kerne der Schalen aus einer Wolframlegierung bestanden. Naturschützer weisen darauf hin, dass Blei den Boden an Orten des Krieges oder der Jagd verschmutzt und es besser wäre, es durch etwas weniger Schädliches zu ersetzen, zum Beispiel durch das gleiche Wolfram. Aber Wolfram ist nicht billig, und Uran mit einer ähnlichen Dichte ist ein schädlicher Abfall. Gleichzeitig ist die zulässige Belastung von Böden und Gewässern mit Uran etwa doppelt so hoch wie bei Blei. Dies geschieht, weil die schwache Radioaktivität von abgereichertem Uran (und sie ist auch 40 % geringer als die von natürlichem Uran) vernachlässigt wird und ein wirklich gefährlicher chemischer Faktor berücksichtigt wird: Uran ist, wie wir uns erinnern, giftig. Gleichzeitig ist seine Dichte 1,7-mal höher als die von Blei, was bedeutet, dass die Größe von Urangeschossen um die Hälfte reduziert werden kann; Uran ist viel feuerfester und härter als Blei – wenn es abgefeuert wird, verdampft es weniger, und wenn es auf ein Ziel trifft, produziert es weniger Mikropartikel. Im Allgemeinen belastet ein Urangeschoss die Umwelt weniger als ein Bleigeschoss, jedoch ist diese Verwendung von Uran nicht sicher bekannt.
Es ist jedoch bekannt, dass Platten aus abgereichertem Uran verwendet werden, um die Panzerung amerikanischer Panzer zu verstärken (dies wird durch ihre hohe Dichte und ihren Schmelzpunkt erleichtert), und auch anstelle von Wolframlegierungen in Kernen für panzerbrechende Projektile. Der Urankern ist auch gut, weil Uran pyrophor ist: Seine heißen kleinen Partikel, die sich bilden, wenn sie auf die Panzerung treffen, flammen auf und setzen alles um sich herum in Brand. Beide Anwendungen gelten als strahlensicher. Die Berechnung ergab also, dass die Besatzung selbst nach einem Jahr ohne Aussteigen aus einem mit Uranmunition beladenen Panzer mit Uranpanzerung nur ein Viertel der zulässigen Dosis erhalten würde. Und um eine jährlich zulässige Dosis zu erhalten, muss diese Munition 250 Stunden lang auf die Hautoberfläche geschraubt werden.
Projektile mit Urankernen - für 30-mm-Flugzeuggeschütze oder für Artillerie-Unterkaliber - wurden von den Amerikanern in den letzten Kriegen eingesetzt, beginnend mit dem Irak-Feldzug des Jahres 1991. In diesem Jahr gossen sie 300 Tonnen abgereichertes Uran auf irakische Panzereinheiten in Kuwait, und während ihres Rückzugs fielen 250 Tonnen oder 780.000 Schuss auf Flugzeuggeschütze. In Bosnien und Herzegowina wurden bei der Bombardierung der Armee der nicht anerkannten Republika Srpska 2,75 Tonnen Uran und beim Beschuss der jugoslawischen Armee in der Provinz Kosovo und Metohija 8,5 Tonnen oder 31.000 Schuss verwendet. Da sich die WHO zu diesem Zeitpunkt um die Folgen des Uraneinsatzes gekümmert hatte, wurde ein Monitoring durchgeführt. Er zeigte, dass eine Salve aus ungefähr 300 Schuss bestand, von denen 80 % abgereichertes Uran enthielten. 10 % trafen die Ziele und 82 % fielen innerhalb von 100 Metern um sie herum. Der Rest verteilte sich innerhalb von 1,85 km. Die Granate, die den Panzer traf, brannte nieder und verwandelte sich in ein Aerosol, leichte Ziele wie gepanzerte Personaltransporter wurden von einer Urangranate durchbohrt. Somit könnten im Irak höchstens anderthalb Tonnen Granaten zu Uranstaub werden. Laut Experten des amerikanischen strategischen Forschungszentrums RAND Corporation haben sich mehr als 10 bis 35 % des verwendeten Urans in ein Aerosol verwandelt. Der kroatische Uranmunitionskämpfer Asaf Durakovich, der in einer Vielzahl von Organisationen vom King Faisal Hospital in Riad bis zum Washington Uranium Medical Research Center gearbeitet hat, glaubt, dass allein im Südirak 1991 3-6 Tonnen Uranpartikel im Submikronbereich entstanden sind. die über ein weites Gebiet verstreut sind, d. h. die Uranverschmutzung dort ist vergleichbar mit Tschernobyl.
Uranus(lat. Uran), u, ein radioaktives chemisches Element der Gruppe III des Periodensystems von Mendelejew, gehört zur Familie Aktiniden, Ordnungszahl 92, Atommasse 238.029; Metall. Natürliches U. besteht aus einer Mischung von drei Isotopen: 238 u - 99,2739 % mit einer Halbwertszeit t 1 / 2 = 4,51 10 9 Jahre, 235 u - 0,7024 % (t 1 / 2 = 7,13 10 8 Jahre) und 234 u - 0,0057% (t 1 / 2 \u003d 2,48 10 5 Jahre). Von den 11 künstlichen radioaktive Isotope mit Massenzahlen von 227 bis 240 langlebig - 233 u (t 1 / 2 \u003d 1,62 10 5 Jahre); es wird durch Neutronenbestrahlung von Thorium gewonnen. 238 u und 235 u sind die Vorläufer zweier radioaktiver Serien.
Geschichtlicher Bezug. U. 1789 eröffnet. Chemiker M. G. Klaproth und von ihm zu Ehren des Planeten Uranus benannt, der von V. Herschel 1781. Im metallischen Zustand wurde U. 1841 von den Franzosen erworben. Chemiker E. Peligo bei der Reduktion von ucl 4 mit metallischem Kalium. Ursprünglich wurde U zugeschrieben Atommasse 120, und erst 1871 D.I. Mendelejew kam zu dem Schluss, dass dieser Wert verdoppelt werden sollte.
lange Zeit Uran war nur für einen engen Kreis von Chemikern interessant und fand nur begrenzte Verwendung für die Herstellung von Farben und Glas. Mit der Entdeckung des Phänomens Radioaktivität W. 1896 u Radium begann 1898 industrielle Verarbeitung Uranerze zur Gewinnung und Verwendung von Radium in der wissenschaftlichen Forschung und Medizin. Seit 1942, nach der Entdeckung des Phänomens der Kernspaltung im Jahr 1939 , U. wurde zum wichtigsten Kernbrennstoff.
Verbreitung in der Natur. U. ist ein charakteristisches Element für die Granitschicht und Sedimenthülle der Erdkruste. Der durchschnittliche U.-Gehalt in der Erdkruste (Clark) beträgt 2,5 10 -4 Gew.-%, in sauren Eruptivgesteinen 3,5 10 -4 %, in Tonen und Tonen 3,2 10 -4 %, in basischen Gesteinen 5 10 -5 % , in ultramafischen Gesteinen des Mantels 3 10 -7%. U. wandert in Form von einfachen und komplexen Ionen, insbesondere in Form von Carbonatkomplexen, stark in kalte und heiße, neutrale und alkalische Wässer. Redoxreaktionen spielen eine wichtige Rolle in der Geochemie von Wasser, da Wasserverbindungen in der Regel in Wässern mit oxidierender Umgebung gut löslich und in Wässern mit reduzierender Umgebung (z. B. Schwefelwasserstoff) schlecht löslich sind.
Etwa 100 U.-Minerale sind bekannt; 12 davon sind von industrieller Bedeutung . Im Laufe der Erdgeschichte hat der U.-Gehalt in der Erdkruste durch radioaktiven Zerfall abgenommen; dieser Prozess ist mit der Akkumulation von Pb- und He-Atomen in der Erdkruste verbunden. Der radioaktive Zerfall von U. spielt eine wichtige Rolle für die Energie der Erdkruste, da sie eine bedeutende Quelle für Tiefenwärme ist.
physikalische Eigenschaften. U. ist farblich ähnlich wie Stahl und lässt sich gut verarbeiten. Es hat drei allotrope Modifikationen - a, b und g mit Phasenumwandlungstemperaturen: a ®b 668,8 ± 0,4 ° C, b® g 772,2 ± 0,4 ° C; a -Form hat ein rhombisches Gitter a= 2,8538 å, b= 5,8662 å, Mit\u003d 4,9557 å), b-Form - tetragonales Gitter (bei 720 ° C a = 10,759 , b= 5,656 å), g-Form - kubisch-raumzentriertes Gitter (bei 850°c ein = 3.538 a). U. Dichte in a-Form (25°C) 19,05 ± 0,2 g/cm 3 , t pl 1132 ± 1°С; t Spitze 3818 °C; wärmeleitfähigkeit (100–200°c), 28.05 Di/(m· Zu) , (200–400 °C) 29,72 Di/(m· Zu) ; Spezifische Wärme (25°C) 27.67 kJ/(kg· Zu) ; spezifischer elektrischer Widerstand bei Raumtemperatur ca. 3 · 10 -7 Ohm· cm, bei 600°C 5,5 · 10 -7 Ohm· cm; hat eine Supraleitung von 0,68 ± 0,02K; schwacher Paramagnet, spezifische magnetische Suszeptibilität bei Raumtemperatur 1,72 10 -6 .
Die mechanischen Eigenschaften von U. hängen von seiner Reinheit, von der Art der mechanischen und thermischen Behandlung ab. Der Mittelwert des Elastizitätsmoduls für Guss U. 20,5 10 -2 Mio./m 2 Reißfestigkeit bei Raumtemperatur 372–470 Mio./m 2 , Festigkeitssteigerung nach Härtung aus b- und g-Phasen; mittlere Härte nach Brinell 19,6–21,6 10 2 Mio./m 2 .
Bestrahlung mit einem Neutronenfluss (der in stattfindet Kernreaktor) verändert das Physische mechanische Eigenschaften U.: Kriechen entwickelt sich und Sprödigkeit nimmt zu, Verformung der Produkte wird beobachtet, was U. dazu zwingt, in Kernreaktoren in Form verschiedener Uranlegierungen verwendet zu werden.
U. - radioaktives Element. Die Kerne 235 u und 233 u spalten spontan, sowie beim Einfang sowohl langsamer (thermischer) als auch schneller Neutronen mit effektiver Querschnitt Abteilungen 508 10 -24 cm 2 (508 Scheune) und 533 10 -24 cm 2 (533 Scheune) beziehungsweise. Kerne 238 u werden gespalten, indem nur schnelle Neutronen mit einer Energie von mindestens 1 eingefangen werden Mev; Wenn langsame Neutronen eingefangen werden, werden 238 u zu 239 pu , dessen Kerneigenschaften nahe bei 235 u liegen. Kritisch Masse U. (93,5 % 235 u) in wässrigen Lösungen ist kleiner als 1 kg, für einen offenen Ball - etwa 50 kg, für einen Ball mit Reflektor - 15 - 23 kg; die kritische Masse von 233 u beträgt etwa 1/3 der kritischen Masse von 235 u.
Chemische Eigenschaften. Externe Konfiguration Elektronenhülle Atom U. 7 s 2 6 d 1 5 f 3 . U. bezieht sich auf reaktive Metalle, weist in Verbindungen Oxidationsstufen + 3, + 4, + 5, + 6, manchmal + 2 auf; die stabilsten Verbindungen sind u (iv) und u (vi). An der Luft oxidiert es langsam unter Bildung eines Dioxidfilms auf der Oberfläche, der das Metall nicht vor weiterer Oxidation schützt. Im Pulverzustand ist U. pyrophor und brennt mit heller Flamme. Mit Sauerstoff bildet es uo 2 -Dioxid, uo 3 -Trioxid und eine große Anzahl von Zwischenoxiden, von denen das wichtigste u 3 o 8 ist. Diese Zwischenoxide haben ähnliche Eigenschaften wie uo 2 und uo 3 . Bei hohen Temperaturen hat uo 2 einen weiten Homogenitätsbereich von uo 1,60 bis uo 2,27. Mit Fluor bildet es bei 500–600 °C Tetrafluorid (grüne nadelartige Kristalle, schwer löslich in Wasser und Säuren) und uf 6 Hexafluorid (eine weiße kristalline Substanz, die bei 56,4 °C sublimiert, ohne zu schmelzen); mit Schwefel - eine Reihe von Verbindungen, von denen Höchster Wert hat uns (Kernbrennstoff). Wenn U. mit Wasserstoff bei 220 ° C wechselwirkt, wird ein Hydrid uh 3 erhalten; mit Stickstoff bei einer Temperatur von 450 bis 700 ° C und atmosphärischem Druck - u 4 n 7 Nitrid, bei mehr hoher Druck Stickstoff und die gleiche Temperatur erhalten Sie un, u 2 n 3 und un 2; mit Kohle bei 750–800°C, Monocarbid uc, Dicarbid uc 2 , sowie u 2 c 3 ; bildet mit Metallen Legierungen verschiedener Art . U. reagiert mit kochendem Wasser langsam zu uo 2 und h 2 , mit Wasserdampf im Temperaturbereich von 150–250 °C; löslich in Salz- und Salpetersäure, leicht - in konzentriert Fluorwasserstoffsäure. Für u (vi) ist die Bildung des Uranylions uo 2 2 + charakteristisch; Uranylsalze sind gelb und gut löslich in Wasser und Mineralsäuren; Salze u (iv) sind grün und weniger löslich; das Uranylion ist zur Komplexbildung in wässrigen Lösungen sowohl mit anorganischen als auch mit organischen Substanzen äußerst befähigt; Die wichtigsten für die Technologie sind Carbonat, Sulfat, Fluorid, Phosphat und andere Komplexe. Eine große Anzahl von Uranaten ist bekannt (Salze nicht isoliert in reiner Form Uransäure), deren Zusammensetzung je nach Herstellungsbedingungen variiert; Alle Uranate haben eine geringe Wasserlöslichkeit.
U. und seine Verbindungen sind strahlen- und chemisch toxisch. Maximal zulässige Dosis (SDA) für berufliche Exposition 5 Rest Im Jahr.
Kassenbon. U. wird aus Uranerzen gewonnen, die 0,05–0,5 % u. Erze werden praktisch nicht angereichert, mit Ausnahme einer begrenzten Methode der radiometrischen Sortierung, die auf der Strahlung von Radium basiert, das immer mit Uran verbunden ist. Grundsätzlich werden Erze mit Lösungen von Schwefelsäure, manchmal Salpetersäure oder Sodalösungen ausgelaugt, wobei U. in eine Säurelösung in Form von uo 2 so 4 oder komplexen Anionen 4- und in eine Sodalösung in Form umgewandelt wird von 4-. Die Sorption an Ionenaustauscherharzen und die Extraktion mit organischen Lösungsmitteln (Tributylphosphat, Alkylphosphorsäuren und Amine) werden verwendet, um Harnsäure aus Lösungen und Pulpen zu extrahieren und zu konzentrieren sowie Verunreinigungen zu entfernen. Weiterhin werden Ammonium- oder Natriumuranate oder Hydroxid u(oh) 4 aus den Lösungen durch Zugabe von Alkali ausgefällt. Um Verbindungen von hoher Reinheit zu erhalten technische Produkte in Salpetersäure gelöst und Raffinerie-Reinigungsoperationen unterzogen, deren Endprodukte uo 3 oder u 3 o 8 sind; Diese Oxide werden bei 650–800 °C mit Wasserstoff oder dissoziiertem Ammoniak zu UO 2 reduziert und anschließend durch Behandlung mit gasförmigem Fluorwasserstoff bei 500–600 °C zu UO 4 umgewandelt. uf 4 kann auch durch Ausfällung des kristallinen Hydrats von uf 4 · nh 2 o aus Lösungen mit Flusssäure, gefolgt von einer Dehydratisierung des Produkts bei 450°C in einem Wasserstoffstrom, erhalten werden. Industriell wird U. aus Uf 4 hauptsächlich durch calcium- oder magnesiumthermische Reduktion gewonnen, wobei U. in Form von Barren mit einem Gewicht von bis zu 1,5 Tonnen anfällt, die in Vakuumöfen veredelt werden.
Höchst wichtiger Prozess in der U.-Technologie ist seine Anreicherung mit dem Isotop 235 u über dem natürlichen Gehalt in Erzen oder die Isolierung dieses Isotops in seiner reinen Form , da es sich bei 235 u um den wichtigsten Kernbrennstoff handelt; dies wird durch Gasthermodiffusion, Zentrifugal- und andere Verfahren durchgeführt, die auf dem Massenunterschied von 235 u und 238 u beruhen; U. wird in Trennprozessen in Form von flüchtigem uf 6 -Hexafluorid verwendet. Bei Erhalt hochangereicherter U. oder Isotope werden deren kritische Massen berücksichtigt; die bequemste Methode ist in diesem Fall die Reduktion von U.-Oxiden mit Calcium; die dabei entstehende Cao-Schlacke wird durch Auflösen in Säuren leicht von U. getrennt.
Pulvermetallurgie wird verwendet, um pulverförmiges Kohlendioxid, Carbide, Nitride und andere feuerfeste Verbindungen zu erhalten.
Anwendung. Metallisches U. oder seine Verbindungen werden hauptsächlich als Kernbrennstoff in verwendet Kernreaktoren. In stationären Reaktoren von Kernkraftwerken wird ein natürliches oder schwach angereichertes Gemisch von U-Isotopen verwendet; das Produkt eines hohen Anreicherungsgrades wird verwendet Atomkraftwerke oder in Reaktoren, die mit schnellen Neutronen arbeiten. 235 u ist die Quelle der Kernenergie in Atomwaffen. 238 u dient als Quelle für sekundären Kernbrennstoff - Plutonium.
V. M. Kulifeev.
Uran im Körper In Mikromengen (10 -5 -10 -5%) kommt es im Gewebe von Pflanzen, Tieren und Menschen vor. In der Asche von Pflanzen (mit einem U.-Gehalt im Boden von etwa 10 -4 ) beträgt seine Konzentration 1,5 10 -5 %. BEI die meisten U. wird von einigen Pilzen und Algen angereichert (letztere sind aktiv an der biogenen Migration von U. entlang der Kette Wasser - Wasserpflanzen - Fische - Mensch beteiligt). U. gelangt mit Nahrung und Wasser in den Magen-Darm-Trakt, mit Luft in die Atemwege sowie über Haut und Schleimhäute in den Körper von Tieren und Menschen. U. Verbindungen werden im Magen-Darm-Trakt absorbiert - etwa 1% der ankommenden Menge löslicher Verbindungen und nicht mehr als 0,1% schwerlöslicher Verbindungen; in der Lunge werden 50 % bzw. 20 % resorbiert. U. ungleichmäßig im Körper verteilt ist. Hauptdepots (Ablagerungs- und Anreicherungsorte) sind Milz, Niere, Skelett, Leber und bei Inhalation schwerlöslicher Verbindungen Lunge und Bronchopulmonale Die Lymphknoten. Das Blut von U. (in Form von Karbonaten und Komplexen mit Proteinen) zirkuliert nicht lange. Der Gehalt an U. in den Organen und Geweben von Tieren und Menschen übersteigt 10 -7 nicht j/j. Das Blut von Rindern enthält also 1 10 -8 g/ml Leber 8 10 -8 j/j, Muskeln 4 10 -8 j/j, Milz 9 10 -8 j/j. U.-Gehalt in menschlichen Organen ist: in der Leber 6 10 -9 j/j, in der Lunge 6 10 -9 -9 10 -9 g / g, in der Milz 4,7 10 -9 j/j, im Blut 4 10 -9 g/ml in den Nieren 5,3 10 -9 (Kortikalschicht) und 1,3 10 -9 j/j(Medulla), in Knochen 1 10 -9 j/j, im Knochenmark 1 10 -9 j/j, im Haar 1,3 10 -7 j/j. U., das im Knochengewebe enthalten ist, verursacht seine ständige Bestrahlung (die Halbwertszeit von U. aus dem Skelett beträgt etwa 300 Tag) . Die niedrigsten Konzentrationen von U. finden sich im Gehirn und im Herzen (10 -10 j/j). Tägliche Aufnahme von U. mit Nahrung und Flüssigkeiten - 1,9 10 -6 g, s Luft - 7 10 -9 G. Die tägliche Ausscheidung von U. aus dem menschlichen Körper beträgt: mit Urin 0,5 10 -7 -5 10 -7, mit Kot - 1,4 10 -6 -1,8 10 -6 g, s Haare - 2 10 -8 g.
Der durchschnittliche U.-Gehalt im menschlichen Körper beträgt nach Angaben der Internationalen Strahlenschutzkommission 9 · 10 -8 g, wobei dieser Wert regional unterschiedlich sein kann. Es wird angenommen, dass U. für das normale Leben von Tieren und Pflanzen notwendig ist, aber seine physiologischen Funktionen wurden nicht aufgeklärt.
GP Galibin.
Giftige Aktion U. ist aufgrund seiner chemischen Eigenschaften und abhängig von der Löslichkeit: Uranyl und andere lösliche Verbindungen von U. sind giftiger U. und seine Verbindungen können in Betrieben zur Gewinnung und Verarbeitung von Uranrohstoffen und anderen Industrieanlagen, wo es sich befindet, vergiftet werden im technologischen Prozess verwendet. Bei Einnahme wirkt U. auf alle Organe und Gewebe und ist ein allgemeines Zellgift. Anzeichen einer Vergiftung wegen Präim. Nierenschäden (das Auftreten von Eiweiß und Zucker im Urin, nachfolgend Oligurie) , auch die Leber und der Magen-Darm-Trakt sind betroffen. Es gibt akute und chronische Vergiftungen; letztere sind gekennzeichnet allmähliche Entwicklung und weniger Symptome. Bei chronischer Vergiftung sind Störungen der Hämatopoese, des Nervensystems usw. möglich Es wird angenommen, dass der molekulare Mechanismus der Wirkung von U. mit seiner Fähigkeit zusammenhängt, die Aktivität von Enzymen zu unterdrücken.
Vergiftungsprävention: Kontinuität technologische Prozesse, die Verwendung versiegelter Geräte, die Vermeidung von Luftverschmutzung, die Abwasserbehandlung vor der Einleitung in Gewässer, Honig. Kontrolle über den Gesundheitszustand der Arbeitnehmer, über die Einhaltung hygienischer Standards für den zulässigen Gehalt an U. und seinen Verbindungen in der Umwelt.
V. F. Kirillov.
Zündete.: Die Lehre von der Radioaktivität. Geschichte und Moderne, hg. B. M. Kedrova, Moskau, 1973. Petrosyants A. M., Von der wissenschaftlichen Suche zur Nuklearindustrie, M., 1970; Emelyanov V. S., Evstyukhin A. I., Metallurgie von Kernbrennstoffen, M., 1964; Sokursky Yu. N., Sterlin Ya. M., Fedorchenko V. A., Uranus und seine Legierungen, M., 1971; Evseeva L. S., Perelman A. I., Ivanov K. E., Geochemistry of uranium in the zone of hydrogenation, 2. Aufl., M., 1974; Pharmakologie und Toxikologie von Uranverbindungen, [transl. aus dem Englischen], Bd. 2, M., 1951; Guskova V. N., Uranus. Strahlenhygienische Kennlinie, M., 1972; Andreeva O. S., Arbeitsschutz bei der Arbeit mit Uran und seinen Verbindungen, M., 1960; Novikov Yu. V. Hygienische Fragen der Untersuchung des Urangehalts in Außenumgebung und ihr Einfluss auf den Körper, M., 1974.
(nach Pauling)
U←U 3+ -1,66 V
U←U 2+ -0,1 V
Geschichte
Schon in der Antike (1. Jh. v. Chr.) wurde natürliches Uran zur Herstellung gelber Glasuren verwendet.
Uran wurde 1789 von dem deutschen Chemiker Martin Heinrich Klaproth (Klaproth) beim Studium des Minerals ("Uran-Teer") entdeckt. Es wurde nach ihm benannt und 1781 entdeckt. In metallischem Zustand wurde Uran 1841 von dem französischen Chemiker Eugene Peligot bei der Reduktion von UCl 4 mit metallischem Kalium gewonnen. Uran wurde 1896 von einem Franzosen entdeckt. Ursprünglich wurde 116 dem Uran zugeschrieben, aber 1871 kam er zu dem Schluss, dass es verdoppelt werden sollte. Nach der Entdeckung von Elementen mit Ordnungszahlen von 90 bis 103 kam der amerikanische Chemiker G. Seaborg zu dem Schluss, dass es richtiger ist, diese Elemente () im Periodensystem in derselben Zelle mit Element Nr. 89 zu platzieren. Diese Anordnung beruht auf der Tatsache, dass die 5f-Elektronen-Unterebene in Aktiniden vervollständigt ist.
In der Natur sein
Uran ist ein charakteristisches Element für die Granitschicht und Sedimenthülle der Erdkruste. Gehalt in der Erdkruste 2,5 · 10 -4 Gew.-%. Im Meerwasser beträgt die Urankonzentration weniger als 10 -9 g/l, insgesamt enthält Meerwasser 10 9 bis 10 10 Tonnen Uran. Uran kommt nicht in freier Form in der Erdkruste vor. Etwa 100 Uranminerale sind bekannt, die wichtigsten davon sind U 3 O 8, Uraninit (U,Th)O 2, Uranharzerz (enthält Uranoxide unterschiedlicher Zusammensetzung) und Tuyamunit Ca [(UO 2) 2 (VO 4 ) 2] 8H 2 Ach
Isotope
Natürliches Uran besteht aus einer Mischung von drei Isotopen: 238 U - 99,2739 %, Halbwertszeit T 1 / 2 = 4,51-10 9 Jahre, 235 U - 0,7024 % (T 1 / 2 = 7,13-10 8 Jahre) und 234 U - 0,0057% (T 1 / 2 \u003d 2,48 × 10 5 Jahre).
Es gibt 11 bekannte künstliche radioaktive Isotope mit Massenzahlen von 227 bis 240.
Das langlebigste - 233 U (T 1 / 2 \u003d 1,62 · 10 5 Jahre) wird durch Bestrahlung von Thorium mit Neutronen erhalten.
Die Uranisotope 238 U und 235 U sind die Vorläufer zweier radioaktiver Serien.
Kassenbon
Die allererste Stufe der Uranproduktion ist die Konzentration. Das Gestein wird zerkleinert und mit Wasser vermischt. Schwere Schwebstoffbestandteile fallen schneller aus. Enthält das Gestein primäre Uranminerale, fallen diese schnell aus: Das sind Schwerminerale. Die Sekundärminerale des Elements #92 sind leichter, in diesem Fall setzt sich das schwere Abfallgestein früher ab. (Es ist jedoch bei weitem nicht immer wirklich leer; es kann viele nützliche Elemente enthalten, einschließlich Uran).
Die nächste Stufe ist das Auslaugen von Konzentraten, die Überführung von Element Nr. 92 in Lösung. Wenden Sie saure und alkalische Laugung an. Ersteres ist billiger, da Uran zum Extrahieren verwendet wird. Aber wenn im Ausgangsmaterial, wie zum Beispiel im Uran Teer, Uran im vierwertigen Zustand ist, dann ist diese Methode nicht anwendbar: vierwertiges Uran in Schwefelsäure ist praktisch unlöslich. Und entweder müssen Sie auf eine alkalische Laugung zurückgreifen oder Uran in einen sechswertigen Zustand voroxidieren.
Verwenden Sie keine Säurelaugung und in Fällen, in denen das Urankonzentrat oder enthält. Es muss zu viel Säure aufgewendet werden, um sie aufzulösen, und in diesen Fällen ist es besser, () zu verwenden.
Das Problem der Uranauslaugung wird durch Sauerstoffspülung gelöst. In einer auf 150°C erhitzten Mischung Uranerz mit Mineralien servieren Flow. Gleichzeitig entsteht es aus schwefelhaltigen Mineralien, die Uran auswaschen.
Aus der entstehenden Lösung muss im nächsten Schritt Uran selektiv isoliert werden. Moderne Methoden- und - dieses Problem lösen.
Die Lösung enthält nicht nur Uran, sondern auch andere. Einige von ihnen verhalten sich unter bestimmten Bedingungen wie Uran: Sie werden mit denselben Lösungsmitteln extrahiert, auf denselben Ionenaustauscherharzen abgeschieden und unter denselben Bedingungen ausgefällt. Daher muss man für die selektive Isolierung von Uran viele Redoxreaktionen anwenden, um auf jeder Stufe den einen oder anderen unerwünschten Begleiter loszuwerden. Auf modernen Ionenaustauscherharzen wird Uran sehr selektiv freigesetzt.
Methoden Ionenaustausch und Extraktion Sie sind auch gut, weil sie es Ihnen ermöglichen, Uran aus schlechten Lösungen ziemlich vollständig zu extrahieren, in einem Liter, von dem sich nur Zehntelgramm Element Nr. 92 befinden.
Nach diesen Operationen wird Uran in einen festen Zustand überführt - in eines der Oxide oder in Tetrafluorid UF 4 . Aber dieses Uran muss noch von Verunreinigungen mit einem großen Einfangquerschnitt für thermische Neutronen gereinigt werden - , . Ihr Gehalt im Endprodukt sollte Hunderttausendstel und Millionstel Prozent nicht überschreiten. Das bereits erhaltene technisch reine Produkt muss also erneut gelöst werden – diesmal in. Uranylnitrat UO 2 (NO 3 ) 2 wird während der Extraktion mit Tributylphosphat und einigen anderen Substanzen zusätzlich auf die gewünschten Bedingungen gereinigt. Dann kristallisiert diese Substanz (oder ausgefälltes Peroxid UO 4 ·2H 2 O) und beginnt sich vorsichtig zu entzünden. Als Ergebnis dieses Vorgangs wird Urantrioxid UO 3 gebildet, das zu UO 2 reduziert wird.
Dieser Stoff ist der vorletzte auf dem Weg vom Erz zum Metall. Bei Temperaturen von 430 bis 600 °C reagiert es mit trockenem Fluorwasserstoff und wird zu UF 4 -Tetrafluorid. Aus dieser Verbindung wird üblicherweise metallisches Uran gewonnen. Erhalten Sie mit der Hilfe oder gewöhnlich.
Physikalische Eigenschaften
Uran ist ein sehr schweres, silbrig-weiß glänzendes Metall. In seiner reinen Form ist es etwas weicher als Stahl, formbar, flexibel und hat leicht paramagnetische Eigenschaften. Uran hat drei allotrope Formen: Alpha (prismatisch, stabil bis 667,7 °C), Beta (quadratisch, stabil von 667,7 bis 774,8 °C), Gamma (mit kubisch-raumzentrierter Struktur, vorhanden von 774,8 °C bis zum Schmelzpunkt). ).
Chemische Eigenschaften
Die chemische Aktivität von metallischem Uran ist hoch. In der Luft wird es mit einem schillernden Film bedeckt. Pulverisiertes Uran, es entzündet sich spontan bei einer Temperatur von 150-175 °C. Bei der Verbrennung von Uran und der thermischen Zersetzung vieler seiner Verbindungen an Luft entsteht Uranoxid U 3 O 8 . Wird dieses Oxid in der Atmosphäre auf Temperaturen über 500 °C erhitzt, entsteht UO 2 . Wenn Uranoxide mit Oxiden anderer Metalle verschmolzen werden, entstehen Uranate: K 2 UO 4 (Kaliumuranat), CaUO 4 (Calciumuranat), Na 2 U 2 O 7 (Natriumdiuranat).
Anwendung
Kernbrennstoff
Uran 235 U hat die größte Anwendung, bei der eine Selbsterhaltung möglich ist. Daher wird dieses Isotop sowohl in als auch in (kritische Masse von etwa 48 kg) als Brennstoff verwendet. Die Isolierung des Isotops U 235 aus natürlichem Uran ist ein komplexes technologisches Problem (siehe). Das Isotop U 238 kann unter dem Einfluss von Beschuss mit hochenergetischen Neutronen spalten, diese Eigenschaft wird verwendet, um seine Leistung zu erhöhen (es werden Neutronen verwendet, die durch eine thermonukleare Reaktion erzeugt werden). Durch Neutroneneinfang und anschließenden β-Zerfall kann 238 U zu 239 werden, das dann als Kernbrennstoff verwendet wird.
In Reaktoren künstlich gewonnenes Uran-233 (durch Bestrahlung mit Neutronen und Umwandlung in und dann in Uran-233) ist Kernbrennstoff für Kernkraftwerke und die Herstellung von Atombomben (kritische Masse von etwa 16 kg). Uran-233 ist auch der vielversprechendste Brennstoff für Gasphasen-Nuklearraketentriebwerke.
Andere Anwendungen
- Eine kleine Zugabe von Uran verleiht dem Glas eine schöne grünlich-gelbe Tönung.
- Uran-235-Karbid in einer Legierung mit Niobkarbid und Zirkoniumkarbid wird als Brennstoff für Kernstrahltriebwerke verwendet (das Arbeitsmedium ist Wasserstoff + Hexan).
- Als starke magnetostriktive Materialien werden Legierungen aus Eisen und abgereichertem Uran (Uran-238) verwendet.
- Zu Beginn des zwanzigsten Jahrhunderts Uranylnitrat ist weithin als ein Verunreinigungsmittel verwendet worden, um getönte fotografische Abzüge herzustellen.
abgereichertes Uran
Nach der Extraktion von U-235 aus natürlichem Uran wird das verbleibende Material als "abgereichertes Uran" bezeichnet, da es am 235. Isotop abgereichert ist. Einigen Berichten zufolge werden in den Vereinigten Staaten etwa 560.000 Tonnen abgereichertes Uranhexafluorid (UF 6) gelagert. Abgereichertes Uran ist halb so radioaktiv wie natürliches Uran, hauptsächlich aufgrund der Entfernung von U-234 daraus. Da die Hauptverwendung von Uran die Energieerzeugung ist, ist abgereichertes Uran ein nutzloses Produkt mit geringem wirtschaftlichem Wert.
Seine Hauptanwendung liegt in der hohen Dichte von Uran und seinen relativ niedrigen Kosten: seine Verwendung für den Strahlenschutz (so seltsam es scheinen mag) und als Ballast in Luft- und Raumfahrtanwendungen wie Flugzeugsteuerflächen. Jedes Flugzeug enthält zu diesem Zweck 1.500 kg abgereichertes Uran. Dieses Material wird auch in Hochgeschwindigkeitskreiselrotoren, großen Schwungrädern, als Ballast in Raumfahrzeugen und Rennyachten beim Bohren von Ölquellen verwendet.
Panzerbrechende Projektilkerne
Die meisten bekannte Verwendung Uran - als Kerne für American. Beim Schmelzen mit 2 % oder 0,75 % und Wärmebehandlung (schnelles Abschrecken des auf 850 °C erhitzten Metalls in Wasser oder Öl, weiteres Halten bei 450 °C für 5 Stunden) wird metallisches Uran härter und fester (Zugfestigkeit beträgt mehr als 1600 MPa, während es für reines Uran 450 MPa sind). In Kombination mit seiner hohen Dichte macht dies den gehärteten Uranbarren zu einem äußerst effektiven Werkzeug zum Durchschlagen von Rüstungen, ähnlich effektiv wie das teurere . Der Prozess der Zerstörung der Panzerung wird begleitet, indem der Uranrohling zu Staub zermahlen und auf der anderen Seite der Panzerung an der Luft entzündet wird. Während der Operation Desert Storm blieben etwa 300 Tonnen abgereichertes Uran auf dem Schlachtfeld (hauptsächlich die Überreste von Granaten der 30-mm-GAU-8-Kanone des A-10-Angriffsflugzeugs, jede Granate enthält 272 g Uranlegierung).
Solche Granaten wurden von NATO-Truppen bei den Kämpfen in Jugoslawien eingesetzt. Nach ihrer Bewerbung wurde darüber diskutiert ökologisches Problem Strahlenbelastung des Landes.
Abgereichertes Uran wird in modernen Panzerpanzern wie dem Panzer verwendet.
Physiologische Wirkung
In Mikromengen (10 -5 -10 -8%) kommt es im Gewebe von Pflanzen, Tieren und Menschen vor. Es reichert sich zum größten Teil durch einige Pilze und Algen an. Uranverbindungen werden im Magen-Darm-Trakt (ca. 1%), in der Lunge - 50% resorbiert. Die Hauptdepots im Körper: Milz und Broncho-Lungen. Der Gehalt in Organen und Geweben von Mensch und Tier übersteigt 10 -7 g nicht.
Uran und seine Verbindungen giftig. Aerosole aus Uran und seinen Verbindungen sind besonders gefährlich. Für Aerosole wasserlöslicher Uranverbindungen beträgt MPC in Luft 0,015 mg/m 3 , für unlösliche Uranformen 0,075 mg/m 3 . Wenn es in den Körper gelangt, wirkt Uran auf alle Organe und ist ein allgemeines Zellgift. Der molekulare Wirkungsmechanismus von Uran hängt mit seiner Fähigkeit zusammen, die Aktivität zu unterdrücken. Zunächst einmal sind sie betroffen (Eiweiß und Zucker treten im Urin auf). In chronischen Fällen sind Störungen der Blutbildung und des Nervensystems möglich.
Uranabbau weltweit
Laut dem 2005 veröffentlichten "Red Book of Uranium" wurden 41.250 Tonnen Uran abgebaut (2003 - 35.492 Tonnen). Laut OECD gibt es weltweit 440 kommerzielle Anwendungen, die 67.000 Tonnen Uran pro Jahr verbrauchen. Das bedeutet, dass seine Produktion nur 60 % seines Verbrauchs deckt (der Rest wird aus alten Atomsprengköpfen geborgen).
Produktion nach Ländern in Tonnen nach U-Gehalt für 2005-2006
Produktion in Russland
Die restlichen 7 % werden durch unterirdisches Auslaugen von CJSC Dalur () und OJSC Khiagda () gewonnen.
Die resultierenden Erze und das Urankonzentrat werden im Chepetsk Mechanical Plant verarbeitet.
siehe auch
Verknüpfungen
Uran (U) ist ein Element mit der Ordnungszahl 92 und dem Atomgewicht 238,029. Es ist ein radioaktives chemisches Element der III. Gruppe des Periodensystems von Dmitry Ivanovich Mendeleev und gehört zur Familie der Aktiniden. Uran ist ein sehr schweres (2,5-mal schwerer als Eisen, mehr als 1,5-mal schwerer als Blei), silbrig-weiß glänzendes Metall. In seiner reinen Form ist es etwas weicher als Stahl, formbar, flexibel und hat leicht paramagnetische Eigenschaften.
Natürliches Uran besteht aus einer Mischung von drei Isotopen: 238U (99,274%) mit einer Halbwertszeit von 4,51∙109 Jahren; 235 U (0,702 %) mit einer Halbwertszeit von 7,13∙108 Jahren; 234 U (0,006 %) mit einer Halbwertszeit von 2,48∙105 Jahren. Das letzte Isotop ist nicht primär, sondern radiogen, es gehört zur radioaktiven Reihe 238U. Die Uranisotope 238U und 235U sind die Vorläufer zweier radioaktiver Serien. Die letzten Elemente dieser Reihe sind die Bleiisotope 206Pb und 207Pb.
Derzeit sind 23 künstliche radioaktive Uranisotope mit Massenzahlen von 217 bis 242 bekannt, von denen 233U mit einer Halbwertszeit von 1,62∙105 Jahren das langlebigste ist. Es wird durch Neutronenbestrahlung von Thorium erhalten, das unter dem Einfluss thermischer Neutronen spaltbar ist.
Uran wurde 1789 von dem deutschen Chemiker Martin Heinrich Klaproth bei seinen Experimenten mit dem Mineral Pechblende entdeckt. Der Name des neuen Elements war zu Ehren des kürzlich (1781) von William Herschel entdeckten Planeten Uranus. Für das nächste halbe Jahrhundert galt die von Klaproth erhaltene Substanz als Metall, aber 1841 wurde dies vom französischen Chemiker Eugene Melchior Peligot widerlegt, der die Oxidnatur des von dem deutschen Chemiker erhaltenen Urans (UO2) bewies. Peligo selbst gelang es, metallisches Uran durch Reduktion von UCl4 mit metallischem Kalium zu gewinnen und das Atomgewicht des neuen Elements zu bestimmen. Der nächste in der Entwicklung des Wissens über Uran und seine Eigenschaften war D. I. Mendeleev - 1874 platzierte er Uran auf der Grundlage der von ihm entwickelten Theorie über die Periodisierung chemischer Elemente in die am weitesten entfernte Zelle seines Tisches. Das zuvor von Peligo bestimmte Atomgewicht von Uran (120) wurde von dem russischen Chemiker verdoppelt, die Richtigkeit solcher Annahmen wurde zwölf Jahre später durch die Experimente des deutschen Chemikers Zimmermann bestätigt.
Viele Jahrzehnte lang war Uran nur für einen engen Kreis von Chemikern und Naturwissenschaftlern interessant, auch seine Verwendung war begrenzt - die Herstellung von Glas und Farben. Erst mit der Entdeckung der Radioaktivität dieses Metalls (1896 durch Henri Becquerel) begann 1898 die industrielle Verarbeitung von Uranerzen. Viel später (1939) wurde das Phänomen der Kernspaltung entdeckt, und seit 1942 ist Uran der wichtigste Kernbrennstoff.
Die wichtigste Eigenschaft von Uran ist, dass die Kerne einiger seiner Isotope spaltbar sind, wenn sie Neutronen einfangen. Als Ergebnis dieses Prozesses wird eine große Menge Energie freigesetzt. Diese Eigenschaft des Elements Nr. 92 wird in Kernreaktoren genutzt, die als Energiequellen dienen, und liegt auch der Wirkung der Atombombe zugrunde. Uran wird in der Geologie zur Altersbestimmung von Mineralien und Gesteinen verwendet, um den Ablauf geologischer Prozesse zu bestimmen (Geochronologie). Da Gesteine unterschiedliche Urankonzentrationen enthalten, weisen sie unterschiedliche Radioaktivität auf. Diese Eigenschaft wird bei der Auswahl von Gesteinen durch geophysikalische Methoden genutzt. Diese Methode wird am häufigsten in der Erdölgeologie zur Bohrlochprotokollierung verwendet. Uranverbindungen wurden als Farben zum Bemalen von Porzellan und für keramische Glasuren und Emails verwendet (eingefärbt in den Farben: gelb, braun, grün und schwarz, je nach Oxidationsgrad), beispielsweise wurde Natriumuranat Na2U2O7 als Gelbpigment in verwendet Malerei.
Biologische Eigenschaften
Uran ist ein ziemlich häufiges Element in der biologischen Umwelt; bestimmte Arten von Pilzen und Algen gelten als Konzentratoren dieses Metalls, die in der Kette des biologischen Urankreislaufs in der Natur nach dem Schema enthalten sind: Wasser - Wasserpflanzen - Fisch - Mann. So gelangt Uran mit Nahrung und Wasser in den Körper von Menschen und Tieren, genauer gesagt in den Magen-Darm-Trakt, wo etwa ein Prozent der eintretenden leichtlöslichen und nicht mehr als 0,1 % der schwerlöslichen Verbindungen aufgenommen werden. In die Atemwege und Lungen sowie in die Schleimhäute und die Haut gelangt dieses Element mit der Luft. In den Atemwegen, insbesondere der Lunge, ist die Aufnahme wesentlich intensiver: leicht lösliche Verbindungen werden zu 50 % und schwerlösliche zu 20 % resorbiert. So kommt Uran in geringen Mengen (10-5 - 10-8%) im Gewebe von Tieren und Menschen vor. In Pflanzen (im Trockenrückstand) hängt die Urankonzentration von seinem Gehalt im Boden ab, so dass bei einer Bodenkonzentration von 10-4 % die Pflanze 1,5∙10-5 % oder weniger enthält. Die Verteilung von Uran in Geweben und Organen ist ungleichmäßig, die Hauptansammlungsorte sind Knochengewebe (Skelett), Leber, Milz, Nieren sowie Lunge und bronchopulmonale Lymphknoten (wenn schwerlösliche Verbindungen in die Lunge gelangen). Uran (Karbonate und Komplexe mit Proteinen) wird schnell aus dem Blut eliminiert. Im Durchschnitt beträgt der Gehalt des 92. Elements in den Organen und Geweben von Tieren und Menschen 10-7%. Beispielsweise enthält das Blut von Rindern 1∙10-8 g/ml Uran, während menschliches Blut 4∙10-10 g/g enthält. Rinderleber enthält 8∙10-8 g/g, beim Menschen im selben Organ 6∙10-9 g/g; Rindermilz enthält 9∙10-8 g/g, beim Menschen 4,7∙10-7 g/g. Im Muskelgewebe von Rindern reichert es sich bis zu 4∙10-11 g/g an. Darüber hinaus ist Uran im menschlichen Körper in der Lunge im Bereich von 6∙10-9 - 9∙10-9 g/g enthalten; in den Nieren 5,3∙10-9 g/g (Rindenschicht) und 1,3∙10-8 g/g (Medulla); im Knochengewebe 1∙10-9 g/g; im Knochenmark 1∙10-8 g/g; im Haar 1,3∙10-7 g/g. Das Uran in den Knochen verursacht eine konstante Bestrahlung des Knochengewebes (der Zeitraum der vollständigen Entfernung des Urans aus dem Skelett beträgt 600 Tage). Am wenigsten dieses Metall im Gehirn und Herz (ca. 10-10 g / g). Wie bereits erwähnt, gelangt Uran hauptsächlich über Wasser, Nahrung und Luft in den Körper. Die tägliche Metalldosis, die mit Nahrung und Flüssigkeiten in den Körper gelangt, beträgt 1,9∙10-6 g, mit Luft - 7∙10-9 g, jedoch wird Uran jeden Tag aus dem Körper ausgeschieden: mit Urin von 0,5∙10-7 g bis 5∙10-7 g; mit Kot von 1,4∙10-6 g bis 1,8∙10-6 g. Verluste mit Haaren, Nägeln und abgestorbenen Hautschuppen - 2∙10-8 g.
Wissenschaftler vermuten, dass Uran in geringen Mengen notwendig ist normale Funktion menschliche, tierische und pflanzliche Organismen. Seine Rolle in der Physiologie wurde jedoch noch nicht aufgeklärt. Es wurde festgestellt, dass der durchschnittliche Gehalt des 92. Elements im menschlichen Körper etwa 9∙10-5 g beträgt (International Commission on Radiation Protection). Allerdings variiert diese Zahl je nach Region und Territorium etwas.
Trotz seiner noch unbekannten, aber eindeutigen biologischen Rolle in lebenden Organismen bleibt Uran eines der gefährlichsten Elemente. Dies äußert sich zunächst in der toxischen Wirkung dieses Metalls, die auf seine chemischen Eigenschaften, insbesondere die Löslichkeit von Verbindungen, zurückzuführen ist. So sind beispielsweise lösliche Verbindungen (Uranyl und andere) giftiger. Vergiftungen mit Uran und seinen Verbindungen treten am häufigsten in Anreicherungsanlagen, Unternehmen zur Gewinnung und Verarbeitung von Uranrohstoffen und anderen Produktionsstätten auf, in denen Uran an technologischen Prozessen beteiligt ist.
Uran dringt in den Körper ein und wirkt sich auf absolut alle Organe und deren Gewebe aus, da die Wirkung auf Zellebene erfolgt: Es hemmt die Aktivität von Enzymen. Betroffen sind vor allem die Nieren, was sich z starker Anstieg Zucker und Eiweiß im Urin, in der Folge Oligurie entwickelnd. Der Magen-Darm-Trakt und die Leber sind betroffen. Die Uranvergiftung wird in akute und chronische unterteilt, wobei sich letztere allmählich entwickelt und asymptomatisch oder mit leichten Manifestationen sein kann. Spätere chronische Vergiftungen führen jedoch zu Störungen der Blutbildung, des Nervensystems und anderen schwerwiegenden Gesundheitsproblemen.
Eine Tonne Granitgestein enthält etwa 25 Gramm Uran. Die Energie, die bei der Verbrennung dieser 25 Gramm in einem Reaktor freigesetzt werden kann, ist vergleichbar mit der Energie, die bei der Verbrennung von 125 Tonnen Kohle in den Öfen starker thermischer Kessel freigesetzt wird! Basierend auf diesen Daten kann davon ausgegangen werden, dass Granit in naher Zukunft als eine der Arten von mineralischen Brennstoffen angesehen wird. Insgesamt enthält die relativ dünne zwanzig Kilometer lange Oberflächenschicht der Erdkruste ungefähr 1014 Tonnen Uran, wenn man sie in ein Energieäquivalent umwandelt, erhält man eine einfach kolossale Zahl - 2.36.1024 Kilowattstunden. Selbst alle erschlossenen, erkundeten und vielversprechenden Lagerstätten brennbarer Mineralien zusammengenommen sind nicht in der Lage, auch nur ein Millionstel dieser Energie bereitzustellen!
Es ist bekannt, dass Uranlegierungen, die einer Wärmebehandlung unterzogen werden, sich durch eine hohe Streckgrenze, Kriech- und erhöhte Korrosionsbeständigkeit, eine geringere Neigung zur Produktveränderung bei Temperaturschwankungen und unter dem Einfluss von Bestrahlung auszeichnen. Basierend auf diesen Prinzipien wurde Anfang des 20. Jahrhunderts bis in die dreißiger Jahre Uran in Form von Karbid zur Herstellung von Werkzeugstählen verwendet. Darüber hinaus ersetzte er Wolfram in einigen Legierungen, was billiger und erschwinglicher war. Bei der Produktion von Ferruran betrug der U-Anteil bis zu 30 %. Im zweiten Drittel des 20. Jahrhunderts wurde eine solche Verwendung von Uran zwar vereitelt.
Wie Sie wissen, findet in den Eingeweiden unserer Erde ein ständiger Zerfallsprozess von Urnenisotopen statt. Wissenschaftler haben also berechnet, dass die sofortige Freisetzung der Energie der gesamten Masse dieses Metalls, eingeschlossen in der Erdhülle, unseren Planeten auf eine Temperatur von mehreren tausend Grad erwärmen würde! Ein solches Phänomen ist jedoch glücklicherweise unmöglich - schließlich wird Wärme allmählich freigesetzt -, da die Kerne von Uran und seinen Derivaten eine Reihe von langfristigen radioaktiven Umwandlungen durchlaufen. Die Dauer solcher Transformationen kann anhand der Halbwertszeiten natürlicher Uranisotope beurteilt werden, beispielsweise beträgt sie für 235U 7108 Jahre und für 238U - 4,51109 Jahre. Uranwärme erwärmt die Erde jedoch erheblich. Wenn es in der gesamten Masse der Erde so viel Uran gäbe wie in der oberen Zwanzig-Kilometer-Schicht, dann wäre die Temperatur auf dem Planeten viel höher als jetzt. Je näher man sich jedoch dem Erdmittelpunkt nähert, desto geringer wird die Urankonzentration.
In Kernreaktoren wird nur ein kleiner Teil des beladenen Urans verarbeitet, dies liegt an der Verschlackung des Brennstoffs mit Spaltprodukten: 235U brennt aus, die Kettenreaktion lässt allmählich nach. Brennstäbe sind jedoch immer noch mit Kernbrennstoff gefüllt, der wiederverwendet werden muss. Dazu werden die alten Brennelemente zerlegt und der Aufbereitung zugeführt – sie werden in Säuren gelöst und aus der entstandenen Lösung das Uran durch Extraktion extrahiert, die zu entsorgenden Spaltfragmente verbleiben in der Lösung. Somit stellt sich heraus, dass die Uranindustrie praktisch eine abfallfreie chemische Produktion ist!
Anlagen zur Trennung von Uranisotopen nehmen eine Fläche von mehreren zehn Hektar ein, ungefähr in der gleichen Größenordnung wie die Fläche poröser Trennwände in den Trennkaskaden der Anlage. Dies liegt an der Komplexität des Diffusionsverfahrens zur Trennung von Uran-Isotopen – schließlich sind mehrere tausend Diffusionsschritte nötig, um die Konzentration von 235U von 0,72 auf 99 % zu erhöhen!
Mit der Uran-Blei-Methode gelang es Geologen, das Alter der ältesten Mineralien herauszufinden, während sie Meteoritengesteine untersuchten, gelang es ihnen, das ungefähre Datum der Geburt unseres Planeten zu bestimmen. Dank der „Uranuhr“ wird das Alter des Mondbodens bestimmt. Interessanterweise stellte sich heraus, dass es seit 3 Milliarden Jahren keine vulkanische Aktivität auf dem Mond gegeben hat und der natürliche Satellit der Erde ein passiver Körper bleibt. Schließlich haben selbst die jüngsten Teile der Mondmaterie länger gelebt als das Alter der ältesten terrestrischen Mineralien.
Geschichte
Die Verwendung von Uran begann vor sehr langer Zeit - bereits im 1. Jahrhundert v. Chr. wurde natürliches Uranoxid zur Herstellung einer gelben Glasur verwendet, die zum Färben von Keramik verwendet wurde.
In der Neuzeit verlief die Erforschung des Urans schrittweise - in mehreren Stufen mit kontinuierlicher Steigerung. Den Anfang machte die Entdeckung dieses Elements im Jahr 1789 durch den deutschen Naturphilosophen und Chemiker Martin Heinrich Klaproth, der die aus sächsischem Harzerz („Uranpech“) abgebaute goldgelbe „Erde“ zu einer schwarzmetallähnlichen Substanz (Uran) zurückführte Oxid - UO2). Der Name wurde zu Ehren des entferntesten Planeten gegeben, der damals bekannt war - Uranus, der wiederum 1781 von William Herschel entdeckt wurde. Damit endet die erste Phase der Erforschung eines neuen Elements (Klaproth war sich sicher, ein neues Metall entdeckt zu haben), es kommt eine Pause von mehr als fünfzig Jahren.
Das Jahr 1840 kann als Beginn eines neuen Meilensteins in der Geschichte der Uranforschung angesehen werden. Seit diesem Jahr beschäftigte sich ein junger Chemiker aus Frankreich, Eugene Melchior Peligot (1811-1890), mit dem Problem der Gewinnung von metallischem Uran, bald (1841) gelang es ihm - metallisches Uran wurde durch Reduktion von UCl4 mit metallischem Kalium erhalten. Außerdem bewies er, dass das von Klaproth entdeckte Uran tatsächlich nur sein Oxid war. Der Franzose bestimmte auch das geschätzte Atomgewicht des neuen Elements - 120. Dann gibt es wieder eine lange Pause bei der Untersuchung der Eigenschaften von Uran.
Erst 1874 tauchen neue Annahmen über die Natur des Urans auf: Dmitri Iwanowitsch Mendelejew findet nach der von ihm entwickelten Theorie zur Periodisierung chemischer Elemente einen Platz für ein neues Metall in seiner Tabelle und platziert Uran in der letzten Zelle. Außerdem erhöht Mendelejew das zuvor angenommene Atomgewicht von Uran um zwei, ohne sich auch darin zu irren, was 12 Jahre später durch die Experimente des deutschen Chemikers Zimmermann bestätigt wurde.
Seit 1896 „fielen“ Entdeckungen auf dem Gebiet der Untersuchung der Eigenschaften von Uran nacheinander: im oben genannten Jahr, ganz zufällig (bei der Untersuchung der Phosphoreszenz von Kaliumuranylsulfatkristallen), der 43-jährige Physikprofessor Antoine Henri Becquerel entdeckt Becquerelstrahlen, die später von Marie Curie in Radioaktivität umbenannt wurden. Im gleichen Jahr entwickelt Henri Moissan (wieder ein Chemiker aus Frankreich) ein Verfahren zur Gewinnung von reinem metallischem Uran.
1899 entdeckte Ernest Rutherford die Inhomogenität der Strahlung von Uranpräparaten. Es stellte sich heraus, dass es zwei Arten von Strahlung gibt - Alpha- und Betastrahlen, die sich in ihren Eigenschaften unterscheiden: Sie tragen eine unterschiedliche elektrische Ladung, haben eine unterschiedliche Weglänge in einer Substanz und auch ihre Ionisierungsfähigkeit ist unterschiedlich. Ein Jahr später wurden Gammastrahlen auch von Paul Villard entdeckt.
Ernest Rutherford und Frederick Soddy entwickelten gemeinsam die Theorie der Uranradioaktivität. Basierend auf dieser Theorie unternahm Rutherford 1907 die ersten Experimente zur Bestimmung des Alters von Mineralien bei der Untersuchung von radioaktivem Uran und Thorium. 1913 führte F. Soddy das Konzept der Isotope ein (vom altgriechischen Iso - „gleich“, „gleich“ und Topos - „Ort“). 1920 schlug derselbe Wissenschaftler vor, Isotope zur Bestimmung des geologischen Alters von Gesteinen zu verwenden. Seine Vermutung erwies sich als richtig: Alfred Otto Karl Nier stellte 1939 die ersten Gleichungen zur Altersberechnung auf und nutzte ein Massenspektrometer zur Trennung von Isotopen.
1934 führte Enrico Fermi eine Reihe von Experimenten zum Beschuss chemischer Elemente mit Neutronen durch - Teilchen, die 1932 von J. Chadwick entdeckt wurden. Als Ergebnis dieser Operation, bisher unbekannt radioaktive Substanzen. Fermi und andere Wissenschaftler, die an seinen Experimenten teilnahmen, schlugen vor, Transurane entdeckt zu haben. Vier Jahre lang wurde versucht, Transurane unter den Produkten des Neutronenbeschusses nachzuweisen. Alles endete 1938, als die deutschen Chemiker Otto Hahn und Fritz Strassmann feststellten, dass beim Einfangen eines freien Neutrons der Kern des 235U-Uranisotops geteilt wird, während eine ausreichend große Energie freigesetzt wird (pro Urankern), hauptsächlich aufgrund von kinetische Energiefragmente und Strahlung. Um weiter voranzukommen, scheiterten die deutschen Chemiker. Lisa Meitner und Otto Frisch konnten ihre Theorie untermauern. Diese Entdeckung war der Ursprung der Nutzung inneratomarer Energie, sowohl für friedliche als auch für militärische Zwecke.
In der Natur sein
Der durchschnittliche Gehalt an Uran in der Erdkruste (Clark) beträgt 3∙10-4 Masse-%, was bedeutet, dass es mehr im Erdinneren ist als Silber, Quecksilber, Wismut. Uran ist ein charakteristisches Element für die Granitschicht und Sedimenthülle der Erdkruste. Also in einer Tonne Granit - etwa 25 Gramm Element Nr. 92. Insgesamt in einem relativ dünnen, zwanzig Kilometer langen, oberste Schicht Die Erde enthält mehr als 1000 Tonnen Uran. In sauren Eruptivgesteinen 3,5∙10-4%, in Tonen und Tonschiefern 3,2∙10-4%, besonders angereichert an organischer Substanz, in basischen Gesteinen 5∙10-5%, in ultrabasischen Gesteinen des Erdmantels 3∙10-7% .
In kalten und heißen, neutralen und alkalischen Wässern wandert Uran in Form von einfachen und komplexen Ionen, insbesondere in Form von Carbonatkomplexen, heftig. Eine wichtige Rolle in der Geochemie von Uran spielen Redoxreaktionen, da Uranverbindungen in der Regel in Wässern mit oxidierender Umgebung gut löslich und in Wässern mit reduzierender Umgebung (Schwefelwasserstoff) schlecht löslich sind.
Mehr als hundert Mineralerze von Uran sind bekannt, sie unterscheiden sich in chemische Zusammensetzung, Herkunft, Konzentration von Uran, von der ganzen Sorte, nur ein Dutzend sind von praktischem Interesse. Die wichtigsten Vertreter des Urans, die in der Natur die größte industrielle Bedeutung haben, können als Oxide angesehen werden - Uraninit und seine Sorten (Nasturan und Uranschwarz) sowie Silikate - Coffinit, Titanate - Davidit und Brannerit; wässrige Phosphate und Uranylarsenate - Uranglimmer.
Uraninit - UO2 ist hauptsächlich in den Urgesteinen des Präkambriums in Form klarer kristalliner Formen vorhanden. Uraninit bildet isomorphe Reihen mit Thorianit ThO2 und Yttrocerianit (Y,Ce)O2. Außerdem enthalten alle Uraniniten radiogene Zerfallsprodukte von Uran und Thorium: K, Po, He, Ac, Pb, sowie Ca und Zn. Uraninit selbst ist ein Hochtemperaturmineral, charakteristisch für Granit- und Syenit-Pegmatite in Verbindung mit komplexen Uran-Niob-Tantal-Titanaten (Columbit, Pyrochlor, Samarskit und andere), Zirkon und Monazit. Darüber hinaus kommt Uraninit in Hydrothermal-, Skarn- und Sedimentgesteinen vor. Große Uraninitvorkommen sind in Kanada, Afrika, den Vereinigten Staaten von Amerika, Frankreich und Australien bekannt.
Nasturan (U3O8), auch bekannt als Uranpech oder Pechblende, das kryptokristalline kollomorphe Aggregate bildet, ist ein vulkanogenes und hydrothermales Mineral, das in paläozoischen und jüngeren Hoch- und Mitteltemperaturformationen vorkommt. Ständige Begleiter der Pechblende sind Sulfide, Arsenide, heimisches Wismut, Arsen und Silber, Karbonate und einige andere Elemente. Diese Erze sind sehr reich an Uran, aber extrem selten, oft begleitet von Radium, das ist leicht erklärt: Radium ist ein direktes Produkt des Isotopenzerfalls von Uran.
Uranschwarze (lose erdige Aggregate) sind hauptsächlich im Jung-Kenozoikum und vertreten jüngere Formationen, sind charakteristisch für hydrothermale Uransulfid- und Sedimentablagerungen.
Uran wird auch in der Form extrahiert Nebenprodukt aus Erzen mit weniger als 0,1 %, beispielsweise aus goldhaltigen Konglomeraten.
Die Hauptvorkommen an Uranerzen befinden sich in den USA (Colorado, North und South Dakota), Kanada (Provinzen Ontario und Saskatchewan), Südafrika (Witwatersrand), Frankreich (Central Massif), Australien (Northern Territory) und vielen anderen Ländern . In Russland ist Transbaikalien die wichtigste Uranerzregion. Etwa 93 % des russischen Urans werden in der Lagerstätte in der Region Chita (in der Nähe der Stadt Krasnokamensk) abgebaut.
Anwendung
Moderne Kernenergie ist ohne das Element Nr. 92 und seine Eigenschaften einfach undenkbar. Obwohl vor nicht allzu langer Zeit - vor dem Start des ersten Kernreaktors - wurden Uranerze hauptsächlich abgebaut, um Radium daraus zu gewinnen. In einigen Farbstoffen und Katalysatoren wurden geringe Mengen an Uranverbindungen verwendet. Tatsächlich wurde Uran als Element von fast keinem industriellen Wert angesehen, und wie dramatisch änderte sich die Situation nach der Entdeckung der Fähigkeit von Uranisotopen zur Spaltung! Dieses Metall erhielt sofort den Status des strategischen Rohstoffs Nr. 1.
Heutzutage ist das Hauptanwendungsgebiet von metallischem Uran sowie seinen Verbindungen der Brennstoff für Kernreaktoren. So wird in stationären Reaktoren von Kernkraftwerken ein schwach angereichertes (natürliches) Gemisch von Uranisotopen verwendet, und in Kernkraftwerken und schnellen Neutronenreaktoren wird Uran mit hohem Anreicherungsgrad verwendet.
Das Uran-Isotop 235U hat die größte Anwendung, weil es zu einer selbsterhaltenden nuklearen Kettenreaktion kommen kann, die für andere Uran-Isotope nicht typisch ist. Dank dieser Eigenschaft wird 235U als Brennstoff in Kernreaktoren sowie in Atomwaffen verwendet. Die Isolierung des 235U-Isotops aus natürlichem Uran ist jedoch ein komplexes und kostspieliges technologisches Problem.
Das in der Natur am häufigsten vorkommende Uranisotop, 238U, kann spalten, wenn es mit hochenergetischen Neutronen beschossen wird. Diese Eigenschaft dieses Isotops wird verwendet, um die Leistung von thermonuklearen Waffen zu erhöhen - es werden Neutronen verwendet, die durch eine thermonukleare Reaktion erzeugt werden. Außerdem wird aus dem 238U-Isotop das Plutonium-Isotop 239Pu gewonnen, das wiederum auch in Kernreaktoren und in der Atombombe eingesetzt werden kann.
BEI In letzter Zeit Von großem Nutzen ist das in Reaktoren aus Thorium künstlich hergestellte Uran-Isotop 233U, das durch Bestrahlung von Thorium im Neutronenfluss eines Kernreaktors gewonnen wird:
23290Th + 10n → 23390Th -(β–)→ 23391Pa –(β–)→ 23392U
233U wird durch thermische Neutronen gespalten, außerdem kann in Reaktoren mit 233U eine erweiterte Reproduktion von Kernbrennstoff erfolgen. Wenn also ein Kilogramm 233U in einem Thoriumreaktor ausbrennt, sollten sich 1,1 kg neues 233U darin ansammeln (als Ergebnis des Einfangens von Neutronen durch Thoriumkerne). In naher Zukunft wird der Uran-Thorium-Zyklus in thermischen Neutronenreaktoren Hauptkonkurrent Uran-Plutonium-Brutzyklus von Kernbrennstoff in schnellen Neutronenreaktoren. Reaktoren, die dieses Nuklid als Brennstoff verwenden, existieren bereits und sind in Betrieb (KAMINI in Indien). 233U ist auch der vielversprechendste Treibstoff für Gasphasen-Kernraketentriebwerke.
Andere künstliche Uranisotope spielen keine nennenswerte Rolle.
Nachdem die „notwendigen“ Isotope 234U und 235U aus natürlichem Uran extrahiert wurden, wird der verbleibende Rohstoff (238U) als „abgereichertes Uran“ bezeichnet, es ist halb so radioaktiv wie natürliches Uran, hauptsächlich aufgrund der Entfernung von 234U daraus. Da die Hauptverwendung von Uran die Energieerzeugung ist, ist abgereichertes Uran aus diesem Grund ein wenig genutztes Produkt mit geringem wirtschaftlichem Wert. Aufgrund seines niedrigen Preises sowie seiner hohen Dichte und seines extrem hohen Einfangquerschnitts wird es jedoch zur Strahlungsabschirmung und als Ballast in Luft- und Raumfahrtanwendungen wie Steuerflächen von Flugzeugen verwendet. Darüber hinaus wird abgereichertes Uran als Ballast in Raumfahrzeugen und Rennyachten verwendet; in Hochgeschwindigkeitskreiselrotoren, großen Schwungrädern, Ölbohrungen.
Die bekannteste Verwendung von abgereichertem Uran ist jedoch seine Verwendung in militärischen Anwendungen - als Kerne für panzerbrechende Projektile und moderne Panzerpanzerung, wie den Panzer M-1 Abrams.
Weniger bekannte Anwendungen von Uran werden hauptsächlich mit seinen Verbindungen in Verbindung gebracht. Eine kleine Zugabe von Uran verleiht Glas eine schöne gelbgrüne Fluoreszenz, einige Uranverbindungen sind lichtempfindlich, aus diesem Grund wurde Uranylnitrat häufig verwendet, um Negative zu verbessern und Positive (Fotoabzüge) braun zu färben (zu färben).
Mit Niobcarbid und Zirkoniumcarbid legiertes Carbid 235U wird als Brennstoff für Kernstrahltriebwerke verwendet. Als starke magnetostriktive Materialien werden Legierungen aus Eisen und abgereichertem Uran (238U) verwendet. Natriumuranat Na2U2O7 wurde als gelbes Pigment in der Malerei verwendet, früher wurden Uranverbindungen als Farben für die Bemalung von Porzellan und für keramische Glasuren und Emails verwendet (eingefärbt in den Farben: gelb, braun, grün und schwarz, je nach Oxidationsgrad) .
Produktion
Uran wird aus Uranerzen gewonnen, die sich in einer Reihe von Merkmalen (je nach Bildungsbedingungen, "Kontrast", Gehalt an nützlichen Verunreinigungen usw.) erheblich unterscheiden, von denen der Hauptanteil der Urananteil ist. Gemäß diesem Merkmal werden fünf Arten von Erzen unterschieden: sehr reich (enthalten über 1 % Uran); reich (1-0,5%); mittel (0,5-0,25%); normal (0,25–0,1 %) und schlecht (weniger als 0,1 %). Aber auch aus Erzen mit 0,01-0,015 % Uran wird dieses Metall als Nebenprodukt gewonnen.
Im Laufe der Jahre der Entwicklung von Uran-Rohmaterialien wurden viele Verfahren zum Trennen von Uran aus Erzen entwickelt. Dies liegt sowohl an der strategischen Bedeutung von Uran in einigen Gebieten als auch an der Vielfalt seiner natürlichen Erscheinungsformen. Doch trotz aller Vielfalt an Methoden und Rohstoffbasis besteht jede Uranproduktion aus drei Stufen: Vorkonzentrierung des Uranerzes; Auslaugung von Uran und Gewinnung ausreichend reiner Uranverbindungen durch Fällung, Extraktion oder Ionenaustausch. Weiterhin folgt je nach Verwendungszweck des entstehenden Urans die Anreicherung des Produkts mit dem 235U-Isotop oder unmittelbar die Reduktion von elementarem Uran.
Also wird das Erz zunächst konzentriert - das Gestein wird zerkleinert und mit Wasser gefüllt. In diesem Fall fallen die schwereren Elemente der Mischung schneller aus. In Gesteinen, die primäre Uranminerale enthalten, erfolgt ihre schnelle Ausfällung, da sie sehr schwer sind. Beim Konzentrieren von Erzen, die sekundäre Uranminerale enthalten, kommt es zur Sedimentation von Abfallgestein, das viel schwerer als sekundäre Mineralien ist, aber sehr nützliche Elemente enthalten kann.
Uranerze werden fast nicht angereichert, abgesehen von der organischen Methode der radiometrischen Sortierung, basierend auf der γ-Strahlung von Radium, die Uran immer begleitet.
Der nächste Schritt in der Uranproduktion ist das Auslaugen, also geht das Uran in Lösung. Grundsätzlich werden Erze mit Lösungen von Schwefelsäure, manchmal Salpetersäure oder Sodalösungen ausgelaugt, wobei Uran in Form von UO2SO4 oder komplexen Anionen in eine saure Lösung und in Form eines 4-Komplex-Anions in eine Sodalösung überführt wird. Das Verfahren mit Schwefelsäure ist billiger, aber nicht immer anwendbar - wenn der Rohstoff vierwertiges Uran (Uranharz) enthält, das sich nicht in Schwefelsäure auflöst. In solchen Fällen wird eine alkalische Laugung verwendet oder das vierwertige Uran wird in den sechswertigen Zustand oxidiert. Die Verwendung von Natronlauge (Ätznatron) ist nützlich beim Auslaugen von magnesit- oder dolomithaltigen Erzen, die zum Auflösen zu viel Säure benötigen.
Nach der Auslaugungsstufe enthält die Lösung nicht nur Uran, sondern auch andere Elemente, die wie Uran mit den gleichen organischen Lösungsmitteln extrahiert werden, auf den gleichen Ionenaustauscherharzen ausfallen und unter den gleichen Bedingungen ausfallen. In einer solchen Situation muss man für die selektive Abtrennung von Uran viele Redoxreaktionen verwenden, um ein unerwünschtes Element auf verschiedenen Stufen auszuschließen. Einer der Vorteile von Ionenaustausch- und Extraktionsverfahren besteht darin, dass Uran aus schlechten Lösungen ziemlich vollständig extrahiert wird.
Nach all diesen Operationen wird Uran in einen festen Zustand überführt - in eines der Oxide oder in UF4-Tetrafluorid. Solches Uran enthält Verunreinigungen mit einem großen Einfangquerschnitt für thermische Neutronen - Lithium, Bor, Cadmium und Seltenerdmetalle. Im Endprodukt sollte ihr Gehalt Hunderttausendstel und Millionstel Prozent nicht überschreiten! Dazu wird das Uran erneut gelöst, diesmal in Salpetersäure. Uranylnitrat UO2(NO3)2 wird während der Extraktion mit Tributylphosphat und einigen anderen Substanzen zusätzlich auf die erforderlichen Bedingungen gereinigt. Diese Substanz wird dann kristallisiert (oder ausgefällt) und sanft gezündet. Als Ergebnis dieses Vorgangs entsteht Urantrioxid UO3, das mit Wasserstoff zu UO2 reduziert wird. Bei Temperaturen von 430 bis 600 ° C reagiert Uranoxid mit trockenem Fluorwasserstoff und verwandelt sich in UF4-Tetrafluorid. Bereits aus dieser Verbindung wird meist mit Hilfe von Calcium oder Magnesium durch konventionelle Reduktion metallisches Uran gewonnen.
Physikalische Eigenschaften
Metallisches Uran ist sehr schwer, es ist zweieinhalb Mal schwerer als Eisen und eineinhalb Mal schwerer als Blei! Dies ist eines der schwersten Elemente, die in den Eingeweiden der Erde gespeichert sind. Mit seiner silbrig-weißen Farbe und Brillanz ähnelt Uran Stahl. reines Metall Kunststoff, weich Hohe Dichte aber gleichzeitig einfach zu verarbeiten. Uran ist elektropositiv, hat unbedeutende paramagnetische Eigenschaften - die spezifische magnetische Suszeptibilität bei Raumtemperatur beträgt 1,72 10 -6, Es hat eine geringe elektrische Leitfähigkeit, aber eine hohe Reaktivität. Dieses Element hat drei allotrope Modifikationen: α, β und γ. Die α-Form hat ein rhombisches Kristallgitter mit folgenden Parametern: a = 2,8538 Å, b = 5,8662 Å, c = 469557 Å. Diese Form ist stabil im Temperaturbereich von Raumtemperatur bis 667,7° C. Die Dichte von Uran in der α-Form bei 25° C beträgt 19,05 ± 0,2 g/cm 3 . Die β-Form hat ein tetragonales Kristallgitter, ist im Temperaturbereich von 667,7 °C bis 774,8 °C stabil. Die Parameter des viereckigen Gitters: a = 10,759 Å, b = 5,656 Å. γ-Form mit kubisch-raumzentrierter Struktur, stabil von 774,8°C bis Schmelzpunkt (1132°C).
Sie können alle drei Phasen im Prozess der Uranreduktion sehen. Dazu wird eine spezielle Vorrichtung verwendet, bei der es sich um ein nahtloses Stahlrohr handelt, das mit Calciumoxid ausgekleidet ist. Es ist erforderlich, dass der Stahl des Rohrs nicht mit Uran interagiert. Eine Mischung aus Uran- und Magnesium- (oder Calcium-) Tetrafluorid wird in die Apparatur geladen, wonach sie auf 600 ° C erhitzt wird. Wenn diese Temperatur erreicht ist, wird eine elektrische Sicherung eingeschaltet, sie fließt sofort exotherme Reduktionsreaktion, während die beladene Mischung vollständig schmilzt. Flüssiges Uran (Temperatur 1132 ° C) sinkt aufgrund seines Gewichts vollständig zu Boden. Nach der vollständigen Abscheidung von Uran auf dem Boden des Apparats beginnt die Abkühlung, Uran kristallisiert, seine Atome reihen sich in einer strengen Reihenfolge auf und bilden ein kubisches Gitter - dies ist die γ-Phase. Der nächste Übergang erfolgt bei 774°C – das Kristallgitter des abkühlenden Metalls wird tetragonal, was der β-Phase entspricht. Wenn die Temperatur des Barrens auf 668° C sinkt, ordnen die Atome ihre Reihen wieder neu, angeordnet in Wellen in parallelen Schichten – der α-Phase. Weitere Änderungen gibt es nicht.
Die Hauptparameter von Uran beziehen sich immer auf die α-Phase. Schmelzpunkt (tmelt) 1132° C, Siedepunkt von Uran (tboil) 3818° C. Spezifische Wärme bei Raumtemperatur 27,67 kJ/(kg K) oder 6,612 cal/(g°C). Der spezifische elektrische Widerstand beträgt bei einer Temperatur von 25 °C etwa 3 · 10 -7 Ohm cm und bereits bei 600 °C 5,5 · 10 -7 Ohm cm. Die Wärmeleitfähigkeit von Uran variiert auch in Abhängigkeit von der Temperatur: Beispielsweise beträgt sie im Bereich von 100-200 ° C 28,05 W / (m K) oder 0,067 cal / (cm sec ° C), und wenn sie auf 400 ansteigt °C steigt sie bis auf 29,72 W/(m K) 0,071 cal/(cm sec °C). Uran hat Supraleitfähigkeit bei 0,68 K. Die durchschnittliche Brinell-Härte beträgt 19,6 - 21,6·10 2 MN / m 2 oder 200-220 kgf / mm 2.
Viele mechanische Eigenschaften des 92. Elements hängen von seiner Reinheit, von der Art der thermischen und mechanischen Verarbeitung ab. Also für gegossenes Uran Reißfestigkeit bei Raumtemperatur 372–470 MN/m 2 oder 38–48 kgf/mm 2 , Durchschnittswert des Elastizitätsmoduls 20,5·10 –2 MN/m2 oder 20,9·10 –3 kgf/mm 2 . Die Festigkeit von Uran nimmt nach dem Abschrecken aus β- und γ-Phasen zu.
Bestrahlung von Uran mit einem Neutronenfluss, Wechselwirkung mit Wasser, das Brennelemente aus metallischem Uran kühlt, und andere Betriebsfaktoren in leistungsstarken thermischen Neutronenreaktoren - all dies führt zu Änderungen der physikalischen und mechanischen Eigenschaften von Uran: Das Metall wird spröde, Kriechen entwickelt sich, Verformung von Produkten aus metallischem Uran tritt auf . Aus diesem Grund werden Uranlegierungen beispielsweise in Kernreaktoren mit Molybdän verwendet, eine solche Legierung ist wasserbeständig, stärkt das Metall und behält gleichzeitig ein kubisches Hochtemperaturgitter bei.
Chemische Eigenschaften
Uran ist chemisch gesehen ein sehr aktives Metall. An der Luft oxidiert es unter Bildung eines schillernden Films aus UO2-Dioxid auf der Oberfläche, der das Metall nicht vor weiterer Oxidation schützt, wie es bei Titan, Zirkonium und einer Reihe anderer Metalle der Fall ist. Mit Sauerstoff bildet Uran UO2-Dioxid, UO3-Trioxid und eine große Anzahl von Zwischenoxiden, von denen das wichtigste U3O8 ist, diese Oxide haben ähnliche Eigenschaften wie UO2 und UO3. Im pulverförmigen Zustand ist Uran pyrophor und kann sich bei leichter Erwärmung (150 °C und darüber) entzünden, die Verbrennung wird von einer hellen Flamme begleitet, die schließlich U3O8 bildet. Bei einer Temperatur von 500-600 ° C interagiert Uran mit Fluor und bildet grüne nadelförmige Kristalle, die in Wasser und Säuren leicht löslich sind - Urantetrafluorid UF4 sowie UF6 - Hexafluorid (weiße Kristalle, die sublimieren, ohne bei einer Temperatur zu schmelzen von 56,4 °C). UF4, UF6 sind Beispiele für die Wechselwirkung von Uran mit Halogenen zur Bildung von Uranhalogeniden. Uran verbindet sich leicht mit Schwefel und bildet eine Reihe von Verbindungen, von denen die wichtigste US-Kernbrennstoff ist. Uran reagiert mit Wasserstoff bei 220°C zu UH3-Hydrid, das chemisch sehr aktiv ist. Beim weiteren Erhitzen zerfällt UH3 in Wasserstoff und Uranpulver. Wechselwirkungen mit Stickstoff treten bei höheren Temperaturen auf - von 450 bis 700 ° C und atmosphärischem Druck wird U4N7-Nitrid erhalten, mit einem Anstieg des Stickstoffdrucks bei gleichen Temperaturen können UN, U2N3 und UN2 erhalten werden. Bei höheren Temperaturen (750–800 °C) reagiert Uran mit Kohlenstoff zu Monocarbid UC, Dicarbid UC2 und U2C3. Uran interagiert mit Wasser unter Bildung von UO2 und H2, langsamer mit kaltem Wasser und aktiver mit heißem Wasser. Außerdem läuft die Reaktion mit Wasserdampf bei Temperaturen von 150 bis 250 °C ab. Dieses Metall löst sich in Salzsäure HCl und Salpetersäure HNO3, weniger aktiv in hochkonzentrierter Flusssäure, reagiert langsam mit Schwefelsäure H2SO4 und Orthophosphorsäure H3PO4. Die Reaktionsprodukte mit Säuren sind vierwertige Uransalze. Aus anorganischen Säuren und Salzen einiger Metalle (Gold, Platin, Kupfer, Silber, Zinn und Quecksilber) kann Uran Wasserstoff verdrängen. Uran interagiert nicht mit Alkalien.
In Verbindungen kann Uran folgende Oxidationsstufen aufweisen: +3, +4, +5, +6, manchmal +2. U3+ kommt nicht natürlich vor und kann nur im Labor gewonnen werden. Fünfwertige Uranverbindungen sind größtenteils instabil und zerfallen ziemlich leicht in quartäre und sechswertige Uranverbindungen, die am stabilsten sind. Sechswertiges Uran ist durch die Bildung des Uranylions UO22+ gekennzeichnet, dessen Salze eingefärbt sind gelb und sind in Wasser und Mineralsäuren gut löslich. Ein Beispiel für Verbindungen des sechswertigen Urans ist Urantrioxid oder Urananhydrid UO3 (orangefarbenes Pulver), das den Charakter eines amphoteren Oxids hat. Beim Auflösen in Säuren entstehen Salze, zum Beispiel Uranchlorid UO2Cl2. Unter Einwirkung von Alkalien auf Lösungen von Uranylsalzen werden Salze der Uransäure H2UO4 erhalten - Uranate und Diuransäure H2U2O7 - Diuranate, beispielsweise Natriumuranat Na2UO4 und Natriumdiuranat Na2U2O7. Vierwertige Uransalze (Urantetrachlorid UCl4) sind grün und weniger löslich. Verbindungen, die vierwertiges Uran enthalten, sind bei längerer Lufteinwirkung normalerweise instabil und werden zu sechswertigen. Uranylsalze wie Uranylchlorid zersetzen sich in Gegenwart von helles Licht oder Bio.