Симптомокомплекс с поражением суставов как осложнение бациллярной дизентерии описал в V века Сеlius Avrelianus как «reumatismus intestinalis сum u1сеrа». В 1965 году А.И.Нестеровым был предложен термин «инфекционно-аллергический полиартрит» для обозначения артритов (артропатий), возникающих на фоне (или после) носоглоточной инфекции. В настоящее время по МКБ-10 инфекционно-аллергические, а также аллергические и поствакцинальные артриты относят к «постинфекционным».
Термин «реактивный артрит» (РеА) впервые был предложен в 1969 году финскими исследователями Р. Аhvоnen, К. Siеvегs и К. Аhо, описавшими артрит при энтероколите иерсиниозной этиологии. При этом подразумевалось, что РеА - это асептический воспалительный процесс в суставе, при котором инфекционные агенты и их антигены отсутствуют. Использование современных методов иммунологического анализа и молекулярных технологий позволяет обнаружить в синовиоцитах у ряда больных РеА не только бактериальные антигены, но и микроорганизмы, способные к размножению (у некоторых больных удается определить бактериальную ДНК). Поэтому более точное определение РеА – это «артрит, ассоциированный с инфекцией».
В современном понимании РеА – это иммунновоспалительное заболевание суставов, которое возникает во время или после кишечного или мочеполового воспалительного процесса (обычно не позже чем через 4-6 недель). Заболевание ассоциированно с антигенами гистосовместимости HLA B-27 и развивается преимущественно у генетически предрасположенных лиц. РеА является системным клиническим проявлением ассоциированной с ним инфекции, относится к группе спондилоартритов. Термин «реактивный артрит» в настоящее время считается общепринятым и используется в классификациях большинства стран. При этом выделяют эпидемическую форму заболевания, вызываемую иерсиниями, шигеллами, сальмонеллами и др., и спорадическую (венерическую), которая развивается при инфицировании Chlamidia trachomatis. Поэтому по этиологии выделяют постэнтероколитические и урогенитальные РеА.
Болезнь Рейтера (БР, уретро-окулосиновиальный синдром) в настоящее время рассматривается как вариант РеА ассоциированный с хламидийной инфекцией. В тоже время синдром Рейтера может развиваться и после перенесенной кишечной инфекции.
Понятие «реактивный артрит» иногда используют для определения артритов, развитие которых связано со стрептококковой, бореллиозной, бруцеллезной, вирусной и другими видами инфекций. Однако связь с НLА-В27 в этих случаях, как правило, отсутствует, не характерными являются спондилоартропатии, поэтому, согласно современной классификации, эти состояния не относятся к РеА.
Классификафия РеА
По этиологии :
- постэнтероколитические (после перенесенной иерсиниозной, сальмонеллезной, кампилобактерной или шигеллезной инфекции);
- урогенитальные (хламидийные – Chlamidia trachomatis, уреаплазменные, микоплазменные).
Потечению:
- острые (в 10 – 15% случаев) – (длительность первичной суставной атаки менее 6 мес., затем симптомы бесследно регрессируют);
- затяжные (до 1 года);
- хронические (протекает без ремиссии, клинические проявления сохраняются свыше 1 года);
- рецидивирующие (с повторными суставными атаками, которые возникают спонтанно после ремиссии заболевания длительностью не менее 6 мес., в связи с обострением уретрита или хламидийной реинфекцией).
По степени активности:
- низкая (I);
- средняя (II);
- высокая (III);
- ремиссия (0);
По степени функциональной недостаточности суставов (ФНС):
- I – профессиональная способность сохранена;
- II – профессиональная способность утрачена;
- III – утрачена способность к самообслуживанию.
Развитие постэнтероколитических реактивных артритов связано, как правило, с эпидемическими вспышками кишечных инфекций, в частности иерсиниозной инфекции в 63% случаев. Острая кишечная инфекция проявляется в виде энтероколита, который продолжается не более 1-2 недель, и проявляется кратковременной диареей, болями в правой подвздошной области (вследствие терминального илеита или мезоденита). Кишечные проявления у ряда больных могут купироваться самостоятельно без назначения антибактериальной терапии. Артрит обычно развивается через 1-3 недели после энтероколита, иногда одновременно с ним, и сопровождается уртикарными, макулопапулезными высыпаниями на туловище и конечностях. Начало артрита обычно острое, процесс локализуется преимущественно в области крупных суставов ног, что типично для реактивного артрита, хотя в воспалительный процесс могут вовлекаться и мелкие суставы кистей рук, лучезапястные и локтевые суставы. При этом моноартрит наблюдается приблизительно в 11 %, олигоартрит – в 39 % , а полиартрит – в 50 % случаев. Нередко развиваются тендовагиниты, в том числе ахиллова сухожилия, бурситы. Характерным является появление узловатой эритемы в области голеней, конъюнктивита. У большинства больных наблюдается полное обратное развитие артрита в течение 4 месяцев. Излечение наступает у 70% больных. Однако у части пациентов (около 30%) развивается хронический серонегативный (по ревматоидному фактору) неэрозивный артрит крупных и средних суставов и/или медленно прогрессирующий сакроилеит. При этом могут отмечаться внесуставные проявления в виде поражения глаз у 25-30 % больных (острый увеит – ирит, иридоциклит, эписклерит, рецидивирующий конъюнктивит) и сердца (миокардит, перикардит). В острый период заболевания повышается температуры тела до 38-39 о С, возникает лейкоцитоз со сдвигом формулы влево, повышается СОЭ. В общем анализе крови наряду с лейкоцитозом и повышенными цифрами СОЭ наблюдаются признаки анемии, в биохимическом анализе крови – повышение уровня альфа2- и Y-глобулинов, фибрина: серомукоида, сиаловых кислот, СРП. Если артрит развился в сроки 7-14 дней от начала заболевания, то в крови определяются антитела к иерсиниям. Серологическое подтверждение инфекции – возрастающий титр антител к иерсиниям, определяемый методом РПГА (диагностический титр 1:160 и выше). При проведении бактериологического исследования из копрокультуры возможно выделение иерсиний. Диагноз дизентерийного РеА подтверждается после выделения копрокультуры шигелл и реакцией непрямой гемаглютинации со стандартными эритроцитарными диагностикумами в титре 1:200 и выше (установлено, что артритогенными свойствами обладает штамм Флекснера). Диагностика сальмонеллезного и кампилобактериального РеА осуществляется путем определения титров антител в крови, реже – при исследовании копрокультуры (ко времени развития реактивного артрита она может быть уже отрицательна).
При исследовании синовиальной жидкости отмечается наличие воспалительного характера экссудата – жидкость мутная, желтоватая, вязкость низкая, количество лейкоцитов (2-100)×10 9 /л, нейтрофилов более 50%, муциновый сгусток хлопьевидный. В экссудате возможно выявление бактериальных антигенов.
Болезнь Рейтера (БР) развивается на фоне хламидийной инфекции, которая передается половым путем и клинически проявляется РеА в сочетании с уретритом (простатитом у мужчин и вагинитом или цервицитом у женщин) и глазными симптомами (конъюнктивитом, передним увеитом), что составляет классическую «триаду Рейтера». При наличии поражений кожи и слизистых оболочек (баланита, кератодермии, изъязвлений слизистой ротовой полости и др.) диагностируют «тетраду Рейтера». В большинстве случаев БР заболевают юноши и молодые мужчины.
Урогенитальная хламидийная инфекция, как правило, протекает мало- или асимптомно. В дебюте заболевания у мужчин нередко наблюдается передний уретрит, появление которого предшествует развитию суставному синдрому. Уретрит развивается через 7-20 дней после инфицирования, но клинические проявления не бывают такими острыми, как при гонорее. Нередко дизурические явления отсутствуют. Стертая клиническая симптоматика уретрита нередко затрудняет диагностику, поскольку большинство больных не обращаются на этой стадии процесса за медицинской помощью. Манифестные формы заболевания регистрируются обычно в тех наблюдениях, где имеет место ассоциированная микст-инфекция. Развитие тотального уретрита наблюдается при хронизации процесса и осложняется хроническим простатитом, эпидидимитом. Конъюнктивит, развивающийся в дебюте заболевания, также может пройти незамеченным для больного, поскольку проявляется небольшим покраснением, зудом, длится 1-2 дня и обычно расценивается как аллергический.
Высокая распространенность заболеваний, передаваемых половым путем с одной стороны и появление новых методов лабораторной диагностики урогенитальных инфекций с другой, помогает установить правильный этиологический диагноз и избежать гипердиагностики ревматоидного артрита. В настоящее время считается, что хламидии – Chlamidia trachomatis являются наиболее значимым этиологическим фактором урогенитальных РеА, при которых возбудитель обнаруживается в соскобах из уретры и цервикального канала в 70-80% случаев. При наличии аногенитальных и орогенитальных контактов хламидии могут выявляться в соскобах из прямой кишки и зева.
(генитальные штаммы, инфицирующие цилиндрический эпителий мочеполового тракта, прямой кишки, глотки и дыхательных путей, а также конъюнктивы);
- Лимфогранулема венерическая – серотипы L1 – L3
Хламидии имеют уникальный двухфазный жизненный цикл, включающий в себя несколько этапов:
1.Инфицирование. При этом элементарные тельца адгезируются на поверхности клеток-мишеней и захватываются ими с образованием везикул.
2.Образование ретикулярных телец . Везикулы с хламидиями двигаются в перинуклеарное пространство и формируют включения внутри цитоплазмы. Форма этих включений различна у разных видов хламидий. Внутри везикул элементарные тельца увеличиваются в размерах с 300 до 1000 нм и превращаются в большие метаболически активные неинфекционные ретикулярные тельца, которые оттесняют ядро клетки-хозяина к периферии.
3.Деление ретикулярных телец . Ретикулярные тельца делятся, образуя большое количество дочерних бактерий.
4.Образование элементарных телец . Вновь образовавшиеся ретикулярные тельца уменьшаются (конденсируются) и превращаются в элементарные тельца (патогенные). Это происходит через 20-30 часов после проникновения хламидий в клетку.
5.Разрыв клеточной стенки и высвобождение вновь образовавшихся инфекционных элементарных телец.
В соответствии с жизненным циклом хламидии имеют 2 формы существования: инфекционную в виде элементарных телец и неинфекционную – ретикулярные тельца. Нормальный жизненный цикл хламидий составляет в среднем 3 суток.
Проблемы детекции возбудителя урогенитального хламидиоза связаны с возможностью существования латентных и персистирующих форм и представляют собой результат нарушения жизненного цикла хламидий в разных фазах. Латентные формы хламидий наблюдаются при ингибировании жизненного цикла на стадии вступления в новый цикл развития (например, сохранение элементарных телец при отсутствии чувствительных клеток-мишеней). Ингибирование перехода внутриклеточных ретикулярных телец в элементарные тельца приводит к персистированию атипичных включений с делящимися ретикулярными тельцами хламидий. При развитии персистентных форм изначально метаболически активные ретикулярные тельца, локализующиеся внутри клетки, могут останавливаться на определенном этапе развития и не превращаются в элементарные тельца. При определенных обстоятельствах они могут длительно находиться внутри клеток, не вызывая разрушения клеточных мембран. Эти промежуточные формы (L- форма) (до 40%) имеют меньшие размеры по сравнению ретикулярными тельцами и не проявляют чувствительности к антибиотикам.
Способность хламидийной инфекции к персистенции связана с зависимостью Chlamidia trachomatis от триптофана. В процессе развития воспаления лимфоциты выделяют y-интерферон, который индуцируют клеточный фермент индоламин-диоксигеназу, разрушающий триптофан. Уменьшение триптофана в окружающей среде приводит или к гибели хламидий, или к замедлению процессов репликации. В результате в эпителиальной клетке начинают накапливаться неинфекционные, неделящиеся ретикулярные тельца, которые сохраняют свою жизнедеятельность, т.е. персистируют. Уменьшение содержания y-интерферона и, соответственно увеличение внутриклеточной концентрации триптофана, приводит к редифференцировке персистирующих форм в инфекционные элементарные тельца, их выходу из клетки и продолжению инфекционного процесса. Существование персистентных форм затрудняет диагностику урогенитального хламидиоза.
Результаты скрининговых исследований показали, что в настоящее время хламидиоз является самой распространенной инфекцией, передаваемой половым путем, особенно среди молодых лиц и подростков. Инфицированность хламидиями клинически здоровых мужчин и женщин в среднем составляет 5-10%. и встречается в 5-7 раз чаще гонококковой. У пациентов с заболеваниями мочеполовой сферы хламидии могут быть обнаружены в 20- 60% случаев.
С клинических позиций необходимо выделять две формы хламидиоза: неосложненный и осложненный. Урогенитальный РеА является осложненной формой урогенитального хламидиоза или уреаплазменной инфекции. На долю урогенитальных артритов приходится 50-75% всех РеА. Урогенитальные РеА клинически проявляются асимметричным мигрирующим моно- или олигоартритом с поражением от 1 до 5 суставов. В дебюте заболевания, как правило, поражаются суставы нижних конечностей: коленные, голеностопные суставы, мелкие суставы стоп. Отмечается подъем температуры у молодых мужчин и подростков до фебрильных цифр, у женщин чаще наблюдается субфебрилитет. Множественное поражение суставов являются более характерными для ревматоидного артрита (РА) и при РеА наблюдаются редко. Ревматоидный фактор в крови больных РеА обычно не обнаруживается.
Основа РеА – острый или подострый экссудативный синовит, поэтому в пораженных суставах доминируют экссудативные проявления в виде болей, воспалительного отека (припухлость), гиперемии и гипертермии, нарушение функции сустава. Нехарактерны для урогенитального РеА хронический пролиферативный синовит, эрозирование суставных поверхностей и деструкция субхондральной кости, подвывихи, девиация и анкилозирование суставов (в отличие от РА). Поражение периферических суставов сопровождается воспалением мягкотканых околосуставных структур – энтезопатиями (энтезитами), что приводит к «сосискообразной» деформации пальцев стоп. Воспаление околосуставных синовиальных сумок (бурситы), сухожильно-связочного аппарата (лигаментиты, тендиниты, теносиновиты) часто проявляется в виде талалгии (боли в пятке), подпяточного бурсита, подошвенного фасциита, ахиллодинии (боли в области ахиллова сухожилия), ахиллотендинита и ахиллобурсита. Нередко поражаются кресцово-подвздошные сочленения, и развивается неанкилозирующий сакроилеит. В редких случаях воспаляются межпозвонковые фасеточные суставы (неанкилозирующий спондилоартрит). Боли в спине при сакроилеите напоминают люмбоишиалгию при грыжах межпозвонковых дисков поясничного отдела позвоночника и носят обычно односторонний характер. Боли и скованность в нижнем отделе позвоночника усиливаются ночью и утром, а днем на фоне движений уменьшаются. В зоне суставных поражений быстро развиваются амиотрофии, которые исчезают в процессе успешного лечения.
Важную роль в развитии этого осложнения играют особенности иммунного ответа макроорганизма на бактериальные антигены, в частности высокая частота ассоциация урогенитальных РеА с HLA-B27, которая наблюдается в 80-90% случаев, что свидетельствует о наличии генетической детерминированности. В патогенезе урогенитального РеА выделяют две фазы: инфекционную (раннюю) и иммунопатологическую (позднюю). В позднюю фазу заболевания редко удается обнаружить микробные антигены. При РеА, ассоциированных с антигеном HLA- B27 могут появляться признаки других заболеваний этой группы – болезни Бехтерева, псориаза, неспецифического язвенного колита, увеита.
Другими частыми возбудителями урогенитальных инфекций являются 3 вида микоплазм из 2 родов: Ureaplasma urealyticum, Mycoplasma bominis и Mycoplasma genitalium, обитающих в мочевыводящих путях и половых органах. Микоплазмы – мельчайшие микроорганизмы, ограниченные трехслойной плазматической мембраной, что определяет их пластичность и многообразие форм. Уреаплазма встречается широко среди населения разных стран, и у клинически здоровых мужчин обнаруживается приблизительно в 13% случаев. Уреаплазма выделяется у 30-50% больных урогенитальным артритом. Характерной особенностью воспалительных заболеваний органов малого таза на современном этапе является тенденция к развитию микст-инфекций (хламидии, уреаплазмы, микоплазмы, трихомонады – до 30%, вирус герпеса – до 23%). При урогенитальном артрите микст-инфекция встречается в 10% случаев. Возможно сочетание гонококковой инфекции с хламидийной и уреаплазменной (у 33% женщин – пациенток венерологической клиники). При этом опасность обсуждаемых инфекций заключается в высокой частоте бессимптомного носительства (до 50% случаев). У женщин чаще всего развивается эндоцервицит, сопровождающийся скудными выделениями из влагалища, и, как правило, они обращаются к гинекологу лишь при появлении осложнений, таких как хронический аднексит, нарушение менструального цикла, бесплодие. Нередким проявлением мочеполовой инфекции является острый или рецидивирующий хронический цистит, хронический пиелонефрит.
Внесуставными проявлениями урогенитальных артритов считаются поражения слизистых оболочек глаз, полости рта, кожи и внутренних органов. Так хламидийный конъюнктивит склонен к рецидивированию, а у 5-10% больных урогенитальными РеА наблюдается более тяжелое поражение глаз – передний увеит, включающий в себя воспаление радужной оболочки и цилиарного тела. Увеит чаще носит односторонний характер и его развитие рассматривается большинством ревматологов в качестве системного проявления заболевания. Для урогенитальных артритов характерно и поражение слизистой оболочки полости рта, в частности, эрозивные или афтозные стоматиты, глосситы. Поражение слизистых может проявляться также в виде рецидивирующего баланита, баланопостита. Важным клиническим синдромом является и поражение кожи ладоней и стоп по типу кератодермии в сочетании с ониходистрофией, онихолизисом. При осмотре волосистой части головы нередко можно обнаружить псориазоподобные бляшки.
Вовлечение внутренних органов в патологический процесс происходит при высокой активности процесса, и длительном течении заболевания. Так увеличение паховых лимфоузлов можно расценивать как регионарную реакцию на воспаление тазовых органов, но в то же время генерализованная лимфоаденопатия рассматривается уже как системное проявление урогенитаьного артрита. Поражение сердца может проявляться как в виде миокардиодистрофии или миокардита, так и в очень редких случаях – перикардита и эндокардита. Неврологические нарушения варьируют от вегетативных расстройств до редких случаев менингита и менингоэнцефалита.
Продолжительность заболевания при остром и подостром течении урогенного артрита составляет 3-6 месяцев, при затяжном течении – до 1 года. У 2/3 больных наблюдается первично хроническое или рецидивирующее течение урогенитального артрита.
Диагностика урогенитального РеА
При лабораторном обследовании у больных РеА обычно выявляются ускореное СОЭ, положительные ревматические пробы (повышение уровня С-рективного белка, серомукоидов, гамма-глобулинов, фибриногена). Ревматоидный фактор не определяется. При определении антигенов гистосовместимости обнаруживается антиген HLA- B27.
Рентгенологические изменения обнаруживаются только при хроническом течении заболевания в виде околосуставного остеопороза, появления «рыхлых пяточных шпор», обызвествленных связок с последующим сужением межсуставной щели и даже появлением эрозий (при многолетнем рецидивирующем процессе). Более ранним рентгенологическим признаком урогенитального артрита является сужение подвздошно-крестцового сочленения.
Для постановки диагноза необходимо исследование соскобов из уретры у мужчин и из цервикального канала у женщин на хламидии и микоплазму. При наличии симптомов хронического простатита показано исследование простатического секрета. В ряде случаев возбудители обнаруживаются в мазках из конъюнктивального мешка, в соскобах из прямой кишки, в утренней порции мочи (обычно при хронических инфекциях мочевыводящих путей). Одним из ответственных этапов диагностики является забор материала для исследования. Для подтверждения диагноза хламидийной инфекции необходимо использование не менее 2 методов одновременно.
Лабораторная диагностика этих инфекций основана на: 1) обнаружении специфических микробных антигенов (метод прямой иммунофлюоресценции (ИФ), иммуноферментный анализ (ИФА) с использованием моноклональных антител к поверхностным антигенам) или 2) обнаружении антител к хламидийным или микоплазменным антигенам (обычно с помощью ИФА). Обнаружение специфических антител в сыворотке крови больных может свидетельствовать как о перенесенной хламидийной или уреаплазменной инфекции, но в тоже время служить и подтверждением урогенитальной природы артрита. Трудности диагностики связаны с отсутствием продукции противохламидийных антител IgA, IgM и IgG в диагностических титрах почти у 40% больных хламидий-индуцированным артритом, однако при этом хламидии могут быть выявлены у части больных цитологическим методом, РИФ и методом посева на среду McCoy. Культуральный метод имеет диагностическое значение только при хронических формах хламидиоза и применяется для контроля эрадикации возбудителя.
В последние годы стали широко применяться молекулярно-генетические методы обнаружения микоплазм и хламидий, в частности, полимеразная цепная реакция (ПЦР) и ДНК-зонды. Особенно информативно для диагностики урогенитальных РеА обнаружение микробных антигенов в синовиальной жидкости, что возможно лишь при значительной экссудации в суставе.
Для диагностики урогенитального хламидиоза предпочтительным является следующий алгоритм обследования:
- Прямая или непрямая иммунофлюоресценция (ПИФ или НПИФ) с культурой клеток или ПЦР-анализ – при диагностики выраженных форм заболевания;
- ИФА для определения бессимптомных или осложненных форм хламидиоза обязательно в комплексе с культурой клеток или ПЦР.
Наиболее чувствительным и специфичным способом определения микоплазменных и уреаплазменных антигенов является ПЦР диагностика и последующий бактериологический контроль эффективности лечения с помощью ПЦР, в комплексе с культуральным исследованием. Высокая чувствительность и специфичность данных методов позволяет обнаружить присутствие минимальных концентраций микробных антигенов, поэтому они широко используются для скрининговых исследований.
Общепринятые критериев диагностики РеА нет. В диагностике урогенитальных артритов, наряду с клиническими особенностями течения заболевания, важную роль играют следующие моменты:
1) хронологическая связь с острой кишечной или урогенитальной инфекцией, вызываемых определенными возбудителями;
2) наличие хронических заболеваний мочеполовой сферы;
3) наличие лабораторных данных о перенесенной триггерной инфекции (например, обнаружение антигенов хламидий и микоплазм (или) антител к ним);
4) обнаружение антигена HLA – B27.
Разработан проект Российских критериев, который включает:
Большие критерии.
1) Артрит (ассиметричный, поражение ограниченного количества суставов (не более 6), преимушественное поражение суставов нижних конечностей);
2) Предшествующая клинически выраженная инфекция (наличие одного из двух проявлений) – уретрит/цервицит, предшествующий артриту на протяжении времени до 8 недель; энтерит, предшествующий артриту за 6 недель и менее.
Малый критерий
Лабораторное подтверждение триггерных инфекций, вызванных Chlamidia trachomatis, либо энтеробактериями (чаще Yersinia enterocolitica, Yersinia pseudotuberculosis, Salmonella enteritidis, Сampylobacter jejuni, Schigella flexneri). Наиболее доказательны положительные результаты выделения Chlamidia trachomatis в культуре клеток и выявление указанных энтеробактерий при посеве кала. В случае отрицательных результатов необходимо подтверждение триггерной инфекции несколькими различными непрямыми методами (для хламидиоза – прямая иммунофлюоресценция, ПЦР,о пределение антител в сыворотке крови; для энтеробактерий – определение антител в сыворотке крови).
Диагноз определенного РеА устанавливают при наличии обоих больших критериев и соответствующего малого критерия. Диагноз вероятного РеА устанавливают при наличии обоих критериев больших критериев или при наличии первого большого критерия и малого критерия.
Согласно классификации МКБ-10 выделяют следующие формы реактивных артритов:
М 02 Реактивные артриты
М 02.3 Болезнь Рейтера (при отсутствии одного из симптомов триады Рейтера выставлять диагноз неправомочно)
М 02.1 Постдизентерийная артропатия
М 02.9 Реактивная артропатия неуточненная
Примеры формулировки диагноза.
1. Болезнь Рейтера (спорадическая форма); уретрит, катаральный конъюнктивит, полиартрит, острое течение. Пяточный бурсит, ахиллодиния. ФНС II.
2. Болезнь Рейтера (спорадическая форма) хроническое течение. Хронический простатит. Полиартрит межфаланговых суставов стоп, плеснофалангових, голеностопного сустава. Синовит левого голеностопного сустава. ФНС II. Пяточный бурсит, кератодермия подошв. Афтозный стоматит.
Патогенез реактивного артрита.
Патогенез РеА до конца не изучен. В частности, нет объяснения наличия артрогенности только у определенных серотипов внутри одного и того же вида различных микробов, в частности хламидий, шигелл. При этом различные микробы обусловливают, по существу, однотипную картину артрита.
Индукторами воспалительных изменений в суставах при постэнтероколитических РеА являются патологические иммунные процессы, возникающие под влиянием микробов в стенке самого кишечника. Иерсинии, шигеллы, сальмонеллы являются пусковыми агентами РеА, поскольку они способны инфицировать слизистую оболочку кишечника и длительное время в ней находиться. Данные возбудители выявляются у 60-70% больных даже при отсутствии клинических симптомов заболевания. В пейеровых бляшках микробные антигены фагоцитируются макрофагами, которые выполняют функцию антиген-презентирующих клеток и передают антиген в ассоциации с Т-клетками В-клеткам.
Таким образом, Т-клетки, активированные микробным антигеном, с одной стороны, стимулируют выработку соответствующих иммуноглобулинов В-лимфоцитами, включая аутоантитела, с другой – могут попадать с кровью и лимфой в полость сустава. При этом возможен перенос внутрь сустава микробных антигенов. Природа факторов, осуществляющих перемещение Т-клеток из кишечника в сустав, до конца не выяснена. Эти факторы получили название хоминг-рецепторы (факторы перемещения лимфоцитов в «среду обитания»). Попадая внутрь сустава, активированные лимфоциты и микробные антигены вызывают иммунное воспаление с участием провоспалительных цитокинов. Изложенная концепция взаимодействия между кишечником и синовией получила название «ось кишечник-сустав». Помимо суставов при постэнтероколитическом РеА возможно поражение глаз, сухожилий, аорты, сердца и др.
Урогенитальный артрит (болезнь Рейтера) . В патогенезе этого варианта РеА основная роль также отводится нарушению клеточного и гуморального звеньев иммунитета с развитием гипериммунного ответа организма на прямую инвазию микроорганизма в полость сустава или на инфекцию, имеющуюся вне сустава. Считается доказанным факт инициации хламидиями и микоплазмами цитотоксического Т-клеточного ответа. При этом пролиферация и активация субпопуляции СD8+ Т-лимфоцитов приводит к повреждению синовиальной оболочки с последующим развитием клинической картины артрита. Образующиеся в большом количестве иммунные комплексы фиксируются в суставных тканях, вызывая гиперпродукцию провоспалительных цитокинов (простагландина E2, интерлейкина-1b, фактора некроза опухолей -a и др.), что приводит к индукции и поддержанию иммуновоспалительного процесса.
Известно, что артритогенный пептид является компонентом клеточной стенки хламидий и по своему антигенному составу гомологичен белку теплового шока. Персистирующие формы хламидий, которые образуются при хроническом течении инфекции, способствуют образованию высокоиммунногенного белка теплового шока с молекулярной массой 60 кДА. Образующиеся в организме хозяина противохламидийные антитела, которые реагируют с антигенами микроорганизма, одновременно являются аутоантителами к собственному белку теплового шока. На сегодняшний день известно около 60 хламидийных пептидов, которые в соответствии со своей аминокислотной последовательностью могут связываться с НLА-В27. Более того, один из таких пептидов (хит – шоковый протеин -70) оказался способным активировать цитотоксические Т-лимфоциты больных РеА. В настоящее время рассматриваются 2 основные гипотезы:
Согласно гипотезе антигенной мимикрии, рецепторное сходство между антигеном НLА-В27 и микробным антигеном способствует его длительной персистенции в организме пациента и стимулирует возникновение аутоиммунного процесса. При этом одним из возможных механизмов инициации урогенного РеА может быть поступление антигенного материала в кровяное русло с его последующим транспортом в суставные ткани.
Теория «артритогенного пептида», согласно которой НLА-В27 является единственной из молекул главного комплекса гистосовместимости I класса, способной представлять артрит-индуцирующий пептид или пептиды цитотоксическим Т-лимфоцитам (популяция СD8+) является более предпочтительной и представлена на схеме 1.
Таким образом, внутриклеточные микроорганизмы могут вызывать повреждение тканей как путем прямого токсического воздействия на клетку-хозяина (цитопатический эффект), так и за счет инициации гипериммунного ответа, который сам индуцирует повреждение тканей (нецитопатический эффект). При этом в отношении самого возбудителя – Chlаmidia trachomatis иммунные реакции оказываются неэффективными. Поэтому при РеА, вызванных Chlаmidia trachomatis, в синовиальных выстилках нередко выявляются жизнеспособные и метаболически активных хламидии.
Кроме того, белок теплового шока – 60 является одним из первых белков, которые синтезируются в организме женщины эпителиальными клетками decidua bazalis после оплодотворения. Поэтому нарушение репродуктивной функции при хламидийной инфекции обусловлено не только нарушением трубной проходимости в результате воспаления, но и специфическим аутоиммунным механизмом, препятствующим развитию плода.
В настоящее время в патогенезе РеА условно выделяют 3 фазы развития: фазу инициации, фазу острого РеА и фазу хронического РеА. В фазу инициации пациент подвергается воздействию провоцирующих бактерий. Клинически это проявляется в виде первичной инфекции (энтероколит или уретрит) с характерной симптоматикой. Полное излечение наблюдается у большинства больных, однако у некоторых развивается РеА. Для фазы острого РеА характерно возникновение периферического синовита. Спондилоартропатии развиваются в основном у носителей HLA-В27 антигена. В фазу хронического РеА, по-прежнему, сохраняется разделение между НLА-В27 положительными и HLА-В27-отрицательными пациентами, но у НLА-В27+ больных имеет место большая вероятность развития рецидивирующих форм заболевания. Кроме того, персистенция инфекции также способствует рецидивированию и хронизации суставного процесса при РеА. Возможна многолетняя персистенция хламидий в полости сустава и поражение ими клеток суставного хряща, которая поддерживает воспалительный процесс и делает малоэффективной стандартную противовоспалительную терапию артрита.
Патоморфология.
Морфологические изменения в синовиальной мембране в острой стадии напоминают инфекционный артрит: отек, гиперемия, инфильтрация нейтрофильными лимфоцитами. В хронических случаях имеется картина неспецифического синовита с умеренным скоплением лимфоидных и плазматических клеток. Синовиальная жидкость содержит от 10000 до 50000 клеток в 1 мл, среди них преобладают нейтрофильные лейкоциты, встречаются цитофагоцитирующие макрофаги, не обладающие какой-либо специфичностью, но названные в свое время «клетками Рейтера».
Терапия реактивных артритов
Принципы терапии РеА ассоциированного с инфекцией вытекают из механизма развития суставного синдрома. Во-первых, необходима санация инфекционного очага в желудочно-кишечном и/или урогенитальном тракте. Во-вторых, следует проводить патогенетическое лечение артрита, включающее в себя неспецифическую противовоспалительную терапию, применение базисных противоревматических средств, иммуномодуляторов и методов локальной терапии.
Требования, предъявляемые к «идеальному» антибиотику для лечения постэнтероколитических и урогенитальных инфекций, следующие:
1) высокая активность в отношении возбудителей (хламидий, уреаплазм, иерсиний и т.д.);
2) накопление препарата в высокой концентрации в тканях;
3) значительная внутриклеточная проницаемость;
4) простота и удобство применения, комплаентность;
5) безопасность применения;
6) экономическая доступность.
Антибактериальная терапия назначается после перенесенной острой кишечной или урогенитальной инфекции с учетом чувствительности к ним выделенных микроорганизмов.
При иерсиниозе используют левомицетин по 2 г/сут, гентамицин по 0,16-0,24 г/сут, тетрациклин по 0,8 г/сут. При шигеллезе применяют левомицетин, сульфаниламидные и нитрофурановые препараты, при сальмонеллезе - левомицетин. Следует отметить, что при лечении левомицетином необходим регулярный контроль показателей крови, так как препарат может вызывать лейкопению. Курс антибактериальной терапии строго индивидуальный и составляет в среднем 2-4 нед. Как правило, при длительной антибактериальной терапии одновременно с профилактической целью назначают противогрибковые препараты (нистатин, пимафуцин, низорал и др.).
Для санации инфекционного очага в урогенитальном тракте используются антибиотики, проявляющие активность в отношении хламидий и микоплазм. В отношении хламидий доказанную эффективность проявляют тетрациклины, макролиды, азалиды и фторхинолоны, в меньшей степени – хлорамфеникол, рифампицин. В отношении уреаплазм наиболее активны макролиды, азалиды и тетрациклины.
Тетрациклины – первая группа антибиотиков, которая стала применяться для лечения хламидиоза и уреаплазмоза. Препараты группы тетрациклина имеют широкий спектр антибактериальной активности, обладают бактериостатическим типом действия, механизм которого связан с нарушением синтеза белка в микробной клетке путем связывания с 30 S – субъединицей РНК рибосом.
Терапия тетрациклином в суточной дозе 1,5-2г в комбинации с нистатином на протяжении 4-6 недель приводила к положительной клинической динамике хламидийного артрита у подавляющего большинства больных. При этом длительное применение высоких суточных доз (до 2 г/сут) тетрациклина в свежих случаях болезни Рейтера давало значительно лучший лечебный эффект, чем при использовании относительно малых доз (до 1 г/сут).
При длительном приеме тетрациклина в высоких дозах нередко возникают побочные эффекты в виде анорексии, тошноты, рвоты, поноса, дисфагии, отмечается повышение активности печеночных ферментов в крови; появление папуллезной и эритематозной кожной сыпи и наблюдается повышенная чувствительность кожи к солнечному свету, проявляющаяся в чрезмерном загаре. Возможно развитие аллергических реакций в виде крапивницы, артралгии (суставная боль) и крайне редко – анафилактический (аллергического) шок. Учитывая возможность проникновения тетрациклинов через плаценту, а также в грудное молоко, они противопоказаны при беременности и в период лактации. Их не рекомендуется назначать детям до 8 лет, поскольку они могут вызвать замедление роста костей, изменение цвета зубов, гипоплазию эмали.
Доксициклин – полусинтетический антибиотик из группы тетрациклинов – был создан в 1967 г. и, по сравнению с тетрациклином, имеет ряд фармакокинетических преимуществ. В частности, доксициклин практически полностью всасывается в ЖКТ, и прием пищи и молочных продуктов меньше влияет на процессы всасывания препарата. У него более длительный, чем у тетрациклина период полувыведения (назначается 1–2 раза в сутки), и хорошее проникновение в различные ткани вследствие липофильности. Доксициклин выводится почками на 40%. В тоже время отсутствует кумуляции препарата в крови при нарушении функции почек, вследствие возрастания выведения его с калом и усиления метаболизма, что дает возможность применять доксициклин у больных с почечной недостаточностью. Благодаря своим особым фармакокинетическим свойствам, доксициклин реже дает побочные эффекты, поэтому препарат более безопасен, чем тетрациклин. При приеме доксициклина моногидрата (препарат «Юнидокс Солютаб») побочные эффекты встречаются еще реже, поскольку доксициклин моногидрат имеет нейтральную реакцию и не вызывает развития эзофагитов, часто встречающихся при применении других форм препарата. При этом диспергируемая форма обеспечивает максимальное удобство пациенту, так как таблетку можно разжевать, проглотить целиком, или растворить в небольшом количестве воды. Доксициклин нашел широкое применение при лечении болезней, передаваемых половым путем, в частности, для лечения больных с острым негонококковым уретритом препарат применяют по 100 мг внутрь дважды в сутки в течение 7 дней. Доксициклин и азитромицин являются препаратами первого ряда при лечении хламидийных инфекций, потекающих бессимптомно, особенно у женщин. Эффективность доксициклина в дозе 200 мг в сутки эквивалентна приему азитромицина в дозе 1 г внутрь однократно, но стоимость лечения азитромицином значительно выше, чем доксициклина. При приеме доксициклина эрадикация хламидий достигается в 100% случаев, а клиническая эффективность препарата составляет 98%. Доксициклин применяют в комбинации с другими антибиотиками (ампициллин/сульбактам, ципрофлоксацин, метронидазол) для лечения воспалительных заболеваний органов малого таза, а также у больных сифилисом при непереносимости β–лактамных антибиотиков.
В литературе имеются сообщения об успешном применении доксициклина у больных ревматологического профиля. Применение этого препарата в дозе 150 мг/сут в течение 3 мес. у больных ревматоидным артритом привело к явной положительной динамике по ряду показателей (суставной счет, интенсивность боли, определяемая по визуальной аналоговой шкале, снижение активности коллагеназы в слюне, различные психопатологические параметры). В ходе пилотного 6–месячного исследования, включавшего 23 больных ревматоидным артритом, эффективность доксициклина была сопоставима с таковой при лечении метотрексатом. Поэтому в настоящее время имеются достаточно веские доказательства, свидетельствующие о целесообразности применения тетрациклинов, в том числе доксициклина, в качестве базисных средств при лечении ревматоидного артрита и остеоартроза. Перспективность работ в данном направлении заслуживает серьезного внимания.
Эффективность других тетрациклиновых препаратов при ревматоидном артрите была изучена в серии клинических исследований. Наиболее демонстративными являются данные двух крупных, выполненных в двойном слепом режиме испытаний полусинтетического тетрациклинового антибиотика миноциклина (Миноцин) у 299 больных ревматоидным артритом. Показано, что назначение миноциклина по 100 мг внутрь дважды в сутки на срок от 24 до 48 недель приводило к статистически значимому улучшению ряда клинических и лабораторных параметров активности болезни (индекс Ричи, число воспаленных суставов, уровень гемоглобина, СОЭ, С-реактивный белок, IgM-ревматоидный фактор) по сравнению с группой больных, получавших индифферентные вещества. Данные результаты заслуживают серьезного внимания и свидетельствуют о явной перспективности работ в этом направлении. Препарат следует принимать за 1 ч до еды или через 2 ч после еды. Пациентам с выраженными нарушениями функции почек и/или печени необходимо назначать препарат в меньшей дозе.
Макролиды рассматриваются как препараты выбора в лечении урогенитального хламидиоза и уреаплазмоза. С этой целью наиболее часто применяются эритромицин, альтернативными препаратами считаются другие макролиды 2 поколения: мидекамицин (макропен), рокситромицин (рулид), спирамицин (ровамицин), джозамицин (вильпрофен). В качестве одного из наиболее безопасных антибиотиков рассматривается эритромицин, который, как и другие макролиды, обладает выраженной бактерицидной активностью в отношении хламидий и микоплазм, вызывающих воспалительные заболевания мочеполовой сферы. Способность макролидов накапливаться в высоких концентрациях в воспалительном очаге, в том числе в полости суставов, связана с тем, что они могут аккумулироваться фагоцитами, которые непосредственно доставляют их в ткани, где имеется воспалительный процесс, наличием «иммуномодулирующего» эффекта, проявляющимся увеличением хемотаксиса фагоцитов, постантибактериальной активностью. Вместе с тем, при энтеральном приеме эритромицина только около 4,5% от введенной дозы выводится в неизмененном виде почками. При внутривенном введении концентрация эритромицина в моче значительно выше, т.к. в этом случае до 15% дозы выводится почками в неизмененном виде. При неосложненом урогенитальном хламидиозе эритромицин назначается по 500мг 4 раза в сутки курсом 7 дней, при воспалительных заболеваниях органов малого таза, ассоциированных с хламидиозом или уреаплазмозом, продолжительность лечения увеличивается до 14 дней. Эритромицин обладает достаточно высокой эффективностью, обеспечивая эрадикацию и излечение больных в 83 – 95% случаев. Курс лечения эритромицином при урогенных артритах должен быть длительным – не менее 4-х недель. Однако в виду частого развития нежелательных реакций со стороны ЖКТ, которые наблюдаются у 38-58% пациенток, они нередко отказываются от его приема. Кроме того, высокая курсовая доза и необходимость 4-хкратного приема снижает комплаентность больных, ограничивает применение эритромицина.
Кларитромицин по своей активности в отношении C.trachomatis и U.urealyticum превосходит эритромицин примерно в 8 раз и обладает улучшенными фармакокинетическими характеристиками. Препарат быстро и полно всасывается в кишечнике, имея большой период полувыведения, длительно циркулирует в плазме в терапевтических концентрациях. Кларитромицин хорошо проникает в ткани с созданием высоких концентраций, значительно превышающих таковые в плазме крови. Препарат выводится с мочой в неизмененном виде (до 20% от введенной дозы). Имеется форма выпуска кларитромицина – СР 500 мг (таблетки медленного высвобождения), которые обеспечивают терапевтическую концентрацию при приеме 1 раз в сутки.
Кларитромицин обладает иммуномодулирующим действием, связанным с активацией моноцитарно-макрофагальной системы, Т-киллеров и ряда ферментов, участвующих в разрушении патогенных бактерий. В нескольких исследованиях была показана эффективность кларитромицина в лечении неосложненных острых уретритов и цервицитов хламидийной и уреаплазменной этиологии. В тоже время терапевтический эффект был гораздо ниже при уретритах смешанной этиологии. Кроме того, при применении кларитромицина отмечен факт нормализации соотношения провоспалительных и регуляторных цитокинов, что выражается в снижении уровней фактора некроза опухоли-α, интерлейкина-8, интерлейкина-6 и повышении уровня интерлейкина-10. Учитывая тот факт, что у пациенток с привычным невынашиванием беременности отмечается нарушение цитокининового баланса в сторону преобладания провоспалительных цитокининов, перспективным является использование данного препарата в качестве предгестационной подготовки у женщин с хроническим воспалительным процессом органов малого таза.
Европейские стандарты лечения хламидийной инфекции предусматривают применение в качестве альтернативного средства рокситромицина по 150мг 2 раза в день. Рокситромицин является 14-членным макролидом, по действию на C.trachomatis и U.urealyticum превосходит эритромицин, тетрациклин и доксициклин. Рокситромицин по степени кумуляции в нейтрофилах превосходит эритромицин и джозамицин. Он способен усиливать фагоцитоз нейтрофилов, ингибирует окислительный «взрыв», в процессе которого в фагоцитах резко нарастает продукция свободных радикалов. При этом отмечается улучшение показателей активности фагоцитов, их переваривающей способности и, в, конечном итоге – завершенного фагоцитоза. Противовоспалительная активность рокситромицина связана с его антиоксидантными свойствами и способностью ингибировать выработку провоспалительных цитокинов – интерлейкина-3, интерлейкина-4, фактора некроза опухоли-α. По выраженности противовоспалительного эффекта он превосходит кларитромицин и азитромицин. Препарат хорошо накапливается в тканях предстательной железы, миометрия, эндометрия. С мочой в неизмененном виде выделяется до 10% препарата. Длительный период полувыведения позволяет назначать препарат в дозе 300 мг 1 раз в сутки. Показана высокая эффективность этого препарата в лечении урогенитальных инфекций. В частности, при негонорейных уретритах рокситромицин применяется в суточной дозе 300мг, продолжительность лечения до 10 дней. Клиническая эффективность при хламидийных уретритах – 75-100%.
Учитывая тот факт, что урогенитальные артриты требуют более длительной антибактериальной терапии, может быть рекомендован повторный курс лечения рокситромицином с интервалом в 5-7 дней. Значительным преимуществом этого препарата является его хорошая переносимость при применении, как у взрослых, так и у детей. Нежелательные реакции развиваются у 3-4% пациентов преимущественно в виде диспептических явлений – боли в животе, тошнота, диарея. Изредка отмечаются головная боль, головокружения, сыпь, лимфопения, эозинофилия, обратимые изменения трансаминаз.
Была также показана высокая эффективность спирамицина (ровамицина) в комплексной терапии урогенитального артрита (Белов Б.С., 1997). Предложены две равнозначные схемы лечения: 1) 6 млн МЕ внутривенно + 3 млн МЕ per os ежедневно в течение 3-х дней, затем по 9 млн МЕ per os в течение 25 дней; 2) 9 млн МЕ per os ежедневно в течение 28 дней.
При соблюдении данных схем лечения хламидийного артрита спирамицином положительная динамика клинических проявлений заболевания наблюдалась у большинства больных, однако эрадикация хламидий при повторном бактериологическом контроле наступила только в 68% случаев. Кроме того, у 8% пациентов отмечались побочные реакции в виде парестезии, развития анемии, аллергического дерматита. Хотя in vitro спирамицин проявляет меньшую, чем эритромицин, активность против C.trachomatis и U.urealyticum, однако его высокая эффективность при лечении РеА, по-видимому, объясняется более высокой концентрацией в моче при внутривенном введении, а также тем, что препарат не взаимодействуют системой цитохромов Р445-Р455. Спирамицин активно проникает внутрь клетки, накапливается в высокой концентрации в тканях половых органов и оказывает длительный постантибиотический эффект. Препарат может применяться у беременных.
Показан хороший клинический эффект макролидов в лечении урогенитальных артритов у детей. В частности им рекомендуется проводить два 7-дневных курса мидекамицина (Макропена) с интервалом в 5 дней (Коровина Н.А. и соавт., 1997). Такая схема по своей эффективности не уступает месячному курсу лечения доксициклином при лечении артритов, ассоциированных с хламидийной инфекцией у детей.
Оценивая эффективность макролидов в лечении урогенитальных артритов, необходимо остановиться на отдельной группе этих препаратов – азалидах, которая представлена азитромицином (Сумамед). В настоящее время азитромицин рассматривается как ведущий препарат, которому отдается предпочтение в лечении урогенитального хламидиоза и уреаплазмоза. Высокий клинический эффект азитромицина во многом обусловлен его фармакокинетическими особенностями, в частности, 1) высокой биодоступностью (не разрушается под действием желудочного сока); 2) высокой липофильностью (концентрация препарата в тканях в десятки и, даже сотни раз, выше, чем в плазме крови); 3) длинным периодом полувыведения – до 3-х суток; 4) высокой внутриклеточной аккумуляцией; 5) более длительным постантибиотическим эффектом.
Благодаря тому, что азитромицин активно аккумулируется в фагоцитах, он переносится ими в очаг воспаления. Концентрация азитромицина в тканях после однократного приема дозы 1 г сохраняется достаточно высокой в течение 10 дней. Важным преимуществом препарата является его хорошая переносимость: частота побочных эффектов не превышает 6%. Среди побочных эффектов преобладают диспептические нарушения. Это делает возможным широкое применение азитромицина в педиатрической и акушерско-гинекологической практике при лечении урогенитального хламидиоза и уреаплазмоза. Многочисленными контролируемыми исследованиями показано, что однократный прием 1г азитромицина приводит к эрадикации хламидий и уреаплазм в 85-100% случаев при остром неосложненном воспалительном процессе. При хроническом урогенитальном хламидиозе применяется курсовая доза 3г по схеме: 1г однократно в 1-й день, затем по 0,5 г в течение последующих 4-х дней. Эрадикационная эффективность азитромицина превосходит таковую при курсовом лечении доксициклином, тетрациклином, эритромицином. В терапии урогенитальных артритов требуются более высокие курсовые дозы азитромицина: 9-12 г в течение 26 дней с различными интервалами. Поэтому несомненный интерес представляют исследования, в которых антибактериальные препараты при лечении урогенитального хламидиоза при РеА применяются прерывистыми курсами,
Эволюция антибиотикочувствительности микоплазм с 2001по 2003 годы показывает рост числа резистентных штаммов к азитромицину, рокситромицину, клиндамицину. В тоже время частота антибиотикоустойчивости к джозамицину, доксициклину и миноциклину не изменилась. Поэтому сравнительные рандомизированные исследования фторхинолонов нового поколения (гатифлокацин, левофлоксацин, моксифлоксацин и др.) с большей в сравнении с ципрофлоксацином и офлоксацином активностью в отношении хламидий и микоплазм, являются актуальными. По активности в отношении хламидий новые фторхинолоны сравнимы с макролидами, а в отношениии микоплазм и уреаплазм столь же эффективны как тетрациклины. Подтверждена эффективность фторхинолонов нового поколения в терапии урогенитального хламидиоза, у лиц, страдающих воспалительными заболеваниями мочеполовой системы с профилактической целью, что представляется особенно важным для комплексной терапии РеА. При лечении неосложненных форм воспалительных заболеваний органов малого таза у женщин моксифлоксацин применяется по 400 мг 1 раз в сутки курсом 14дней. По своей эффективности препарат был равен комбинации ципрофлоксацина (500мг оджнократно), доксициклина 100 мг 2 раза в сутки и метронидазола 500 мг 3 раза в сутки в течение 14 дней при сравнимой эффективности микробиологической эффективности соответственно 92.5% и 88,2%.
Побочные эффекты являются типичными для всех представителей фторхинолонов (встречаются у 27,4% пролеченных больных): 1) со стороны центральной нервной системы – головокружение, рассеянность внимания, головная боль; 2) со стороны желудочно-кишечного тракта – сухость и «металлический» привкус во рту, чувство дискомфорта в эпигастрии, тошнота; 3) явления фотосенсибилизации и кожная сыпь с зудом. Кроме того, частота их возникновения может зависеть от совместного применения с другими лекарственными препаратами, которые также используются при лечении РеА, в частности с НПВП. Вследствие выраженности побочных эффектов препараты были отменены у 3,8% больных.
При лечении хламидиозной инфекции при беременности рекомендованы следующие препараты: эритромицин 500мг 4 раза в день 7 дней, амоксициллин 500 мг внутрь 3 раза в сутки 7 дней или джозамицин 750 мг 2 раза в сутки в течение 7 дней.
Амоксициллин является полусинтетическим антибиотиком из группы пенициллинов широкого спектра действия. Применение пенициллинов во время беременности имеет почти 50-летнюю историю, поэтому безопасность их не вызывает сомнений. Амоксициллин не обладает нефро- и гепатотоксическим действием. Пенициллины не действуют на C. Trachomatis, но могут частично проникать внутрь клетки,где их концентрация составляет 60% от концентрации в плазме крови. Тем не менее, в сравнительном исследовании азитромицина с 7-дневный курсом лечения амоксициллином по 500мг 3 раза в сутки были показаны сходные результаты, как в оценке эффективности, так и переносимости. Рекомендации CDC (Атланта, США) состоят в применении амоксициллина в случае неэффективности лечения эритромицином.
С 2001 г. Европейское руководство по лечению инфекций, передающихся половым путем, предусматривает применение джозамицина для лечения хламидийной инфекции у беременных. Молекула джозамицина имеет 16-членное лактонное кольцо. Джозамицин обладает менее выраженными нежелательными реакциями по сравнению с другими макролидами, так как он не связывается с цитохромами Р445 –Р455 и не угнетает их активность. Поэтому препарат не имеет побочных эффектов со стороны ЖКТ и не оказывает гепатотоксического действия. Джозамицин после приема быстро распределяется в тканях, а также в макрофагах периферической крови. Его способность проникать внутрь клетки в 20 раз выше, чем во внеклеточном пространстве. Высокая эффективность при лечении хламидийной инфекции у беременных достигается при применении препарата в дозе 750мг 2 раза в сутки 7 дней.
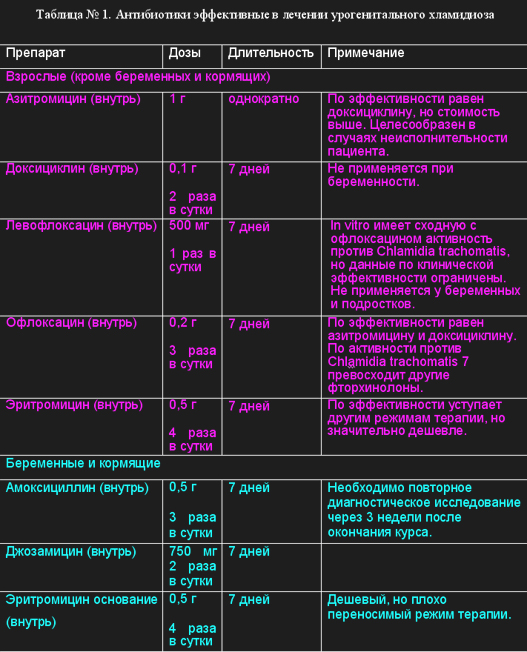
В настоящее время федерального протокола лечения хламидиоза не существует, связи с чем, используется шаблон комплексного лечения, который включает применение 2-3 антибактериальных препаратов, интерферонов, иммуномодуляторов, «системной энзимотерапии», антиоксидантов и витаминов. Антибиотики эффективные в лечении неосложненных форм уретрального, цервикального и ректального хламидиоза представлены в таблице №1.
Лечение осложненных форм хламидиоза представляет сложную задачу, поскольку практически у всех больных воспалительный процесс не ограничивается уретрой, а распространяется на вышележащие отделы урогенитального тракта, что значительно затрудняет достижение эрадикации возбудителя. Кроме того, в последние годы активно нарастает резистентность хламидийной инфекции и артритов к проводимой антибактериальной терапии. Известно, что носителями видовых признаков хламидий являются мобильные структуры, представляющие собой замкнутые кольца двухнитиевой ДНК – их называют плазмидами. Плазмиды изначально невосприимчивы к нескольким антибиотикам или к целой их группе, в частности к β-лактамным антибиотикам. Плазмиды могут интегрироваться в хромосому и реплицироваться с ней. Благодаря этому информация о резистентности к ряду антибиотиков передается непосредственно в генетический аппарат хламидийной клетки и хламидия становится нечувствительной к данным препаратам. Это обстоятельство может служить объяснением того факта, что 7 дневные курсы антибиотикотерапии, применяемые для лечения неосложненного урогенитального хламидиоза, совершенно неэффективны при воспалительных заболеваниях малого таза и РеА, ассоциированном с хламидийной инфекцией.
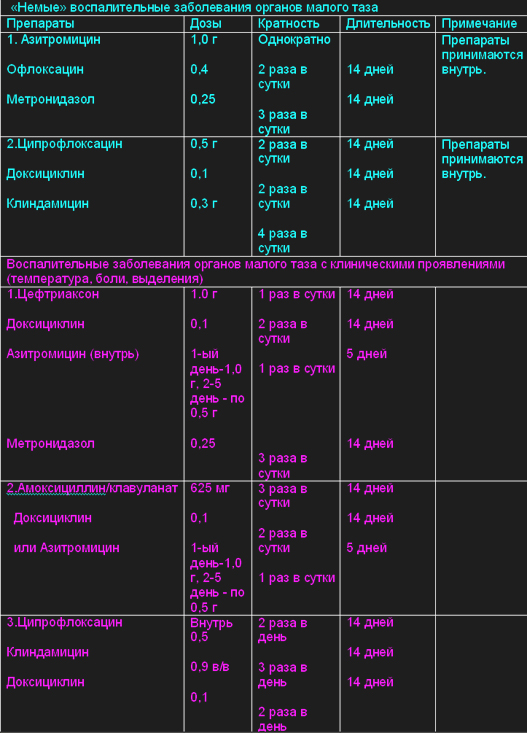
В таблице №2 даны режимы антибактериальной терапии осложненных форм урогенитального хламидиоза.
Таблица №2 Режимы антибактериальной терапии осложненных форм урогенитального хламидиоза.
Хотя убедительных данных о влиянии антибиотиков на течение суставного синдрома не получено, тем не менее, при устранении хламидийной инфекции реже возникают рецидивы и хроническое течение заболевания. Поэтому обоснованным считается раннее назначение антибактериальной терапии, что позволяет в ряде случаев предупредить развитие урогенитальных артритов. При неосложненном хламидиозе следует минимизировать объем терапии и назначать только препараты направленного действия, эффективность которых в лечении хламидиоза имеет доказательную базу. Только при отсутствии эффекта от рекомендованных стандартных схем рекомендуется применять комбинированную терапию. В случаях неосложненного хламидиоза применение комбинированной антибактериальной терапии не обосновано, так как нет убедительных доказательств ее эффективности. В тоже время частота бактериологических неудач при лечении болезни Рейтера может достигать 40%, поэтому приходится нередко применять схемы, включающие 2-3 антибактериальных препарата, особенно при лечении рецидивирующих и хронических форм хламидиоза.
В тоже время для ревматологов интерес к антибактериальным препаратам отнюдь не ограничивается их непосредственным противомикробным действием. Не меньшего внимания заслуживают неспецифические противовоспалительные эффекты, которыми обладает ряд антибактериальных препаратов.
В настоящее время имеются убедительные доказательства способности тетрациклинов ингибироать матриксные металлопротеиназы – специфические цинкозависимые ферменты (коллагеназы, желатиназы, стромелизины и др.), которые играют важную роль в разрушении макромолекул внеклеточного матрикса соединительной ткани. Предполагают, что при ревматоидном артрите и остеоартрозе имеются локальные нарушения баланса между продукцией активированных форм металлопротеиназ и их тканевыми ингибиторами. Следует также учитывать высокую степень проникновения тетрациклинов и особенно доксициклина в хрящевую ткань, субхондральный костный слой и синовиальную оболочку в присутствии флурбипрофена и возрастание его концентрации в тканях при длительном применении (от 12 до 18 мес).
Результаты многочисленных экспериментальных и клинических работ показывают, что макролиды также обладают противовоспалительным действием, не связанным с их антибактериальной активностью. Это выражается в ингибировании продукции нейтрофильных протеиназ и экспрессии клеточных молекул адгезии на нейтрофилах, в подавлении синтеза провоспалительных цитокинов, угнетении активации энергетического метаболизма в фагоцитирующих клетках (подавление окислительного стресса). Макролиды уменьшают образование кислородных свободных радикалов при сохранении бактерицидной активности нейтрофилов, а также росте эндогенной продукции глюкокортикостероидов. При этом макролиды хорошо переносятся больными и редко дают серьезные побочные эффекты, требующие отмены препаратов, что позволяет применять их в течение достаточно длительного времени (до 12 месяцев и более).
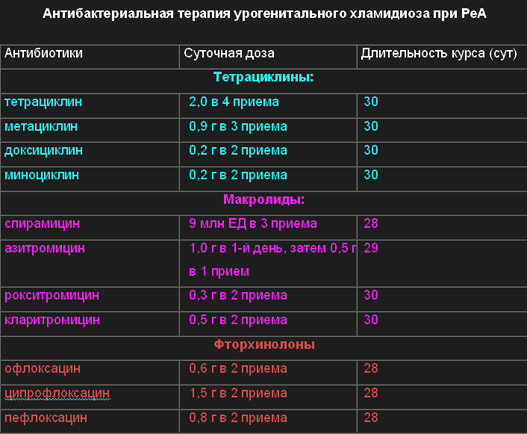
В таблице №3 представлены антибиотики, обладающие наиболее высокой антихламидийной активностью, которые применяются в комплексном лечении урогенитальных РеА и продолжительность их применения.
Таблица№3
Лечение РеА обычно начинают одним из антибиотиков из группы макролидов или тетрациклинов, а фторхинолоны используют в качестве препаратов второго ряда. Курс лечения должен составлять не менее 4 недель с последующим ежемесячным (как минимум трехкратным) бактериологическим контролем. При выявлении сопутствующей патогенной или условно-патогенной микрофлоры мочеполового тракта возможно одновременное или последовательное назначение двух или даже трех антибиотиков. В тоже время применение β-лактамных препаратов (пенициллины, цефалоспорины), сульфаниламидов, низких доз гамма-интерферона, неоправданно коротких курсов и низких доз антибиотиков может способствовать образованию L-подобных форм хламидий, резистентных практически ко всем известным антибактериальным средствам.
С целью предотвращения формирования антибиотикорезистентности при проведении повторных курсов лечения необходима смена препаратов. При применении макролидов рекомендуется назначение рациональных комбинаций антибиотиков (макролиды + доксициклин), назначение достаточных по длительности сроков антибактериальной терапии лечение обоих половых партнеров с использованием одинаковых комбинаций антибиотиков.
Таким образом, лечение РеА артритов представляет трудную задачу, решение которой, вместе с тем, возможно при соблюдении определенных условий:
1.Своевременное проведение адекватной антибактериальной терапии с учетом современных рекомендаций по длительности применения антибиотиков. Обязательный контроль эффективности лечения РеА и достижение эрадикации возбудителя;
2.Индивидульный подбор нестероидных противовоспалительных препаратов (НПВП) с учетом клинического эффекта и переносимости препарата;
3.Локальная терапия глюкокортикростероидов (ГКС) при наличии высокой активности артрита;
4.Применение базисных препаратов при затяжном и хроническом течении артрита;
5.Активное применение локальной терапии ДМСО на ранних сроках заболевания;
6.Включение ФТЛ, ЛФК, санаторно-курортного лечения в комплекс реабилитационных мероприятий.
Фармакотерапия суставного синдрома при РеА должна начинаться с применения нестероидных противовоспалительных препаратов.
Выбор НПВП осуществляется эмпирически, однако при подборе того или иного препарата важную роль играет индивидуальная чувствительность и переносимость. Хорошо зарекомендовали себя в лечении РеА производные индолуксусной кислоты (индометацин, сулиндак). Они обладают высокой противовоспалительной активностью, накапливаются в синовиальной жидкости в высокой концентрации, превышающей в несколько раз концентрацию их в плазме крови. Препараты данной группы рассматриваются некоторыми авторами как препараты первого ряда в лечении серонегативных спондилоартропатий. При лечении РеА широко применяются также НПВП из группы производных пропионовой кислоты (ибупрофен, напроксен, кетопрофен, флугалин, тиапрофеновая кислота), производные арилуксусной кислоты (диклофенак), оксикамы (пироксикам, мелоксикам, лорноксикам) в стандартных суточных дозах. Однако при лечении РеА противовоспалительный эффект НПВП, в отличие от аналгетического и жаропонижающего, развивается только через 10–14 дней от начала регулярного приема, а при назначении пироксикама или других оксикамов еще позднее. Рекомендуется начинать прием любого НПВП начинать с наименьшей терапевтической дозы, рекомендуемой при данном заболевании. При хорошей переносимости, обычно через 2–3 дня, следует постепенно увеличивать (титровать) суточную дозировку в течение 1–2 недель до эффективной терапевтической дозы. При этом доза НПВП, получаемая больным, не должна превышать максимально рекомендуемую суточную дозу. Увеличение суточных доз НПВП более чем в 2 раза, как правило, не сопровождается пропорциональным нарастанием противовоспалительного действия, но быстро приводит к развитию нежелательных дозозависимых побочных эффектов. Поэтому при отсутствии эффекта от НПВП необходимо решать вопрос о переводе больного на другие препараты, в частности подключении ГКС, базисных противоревматических препаратов. При необходимости длительного курсового назначения (например, в ревматологии) НПВП следует назначать после приема пищи. Важна также синхронизация назначения НПВП с ритмом клинической активности процесса, что позволяет, используя меньшие дозы НПВП, повысить эффективность лечения, особенно при применении короткоживущих препаратов с периодом полувыведения 4–5 час. Момент приема НПВП может определяться также временем максимальной выраженности симптомов заболевания (боль, скованность в суставах). При этом можно назначать НПВП в любое время суток, отходя от общепринятых схем введения, что позволяет достигать большего лечебного эффекта при назначении препарата в меньшей суточной дозе. При приеме НПВП предпочтение следует отдавать монотерапии. Одновременное применение двух или более НПВП нецелесообразно по следующим причинам. Во-первых, эффективность комбинированного применения НПВП объективно не доказана. Только у некоторых больных в порядке исключения и при хорошей переносимости можно применять два НПВП, которые в этих случаях назначают в разное время суток, например быстровсасывающийся – утром и днем, а длительнодействующий – вечером. Однако в ряде подобных случаев отмечалось снижение концентрации препаратов в крови (например, АСК снижает концентрацию индометацина , диклофенака , ибупрофена , напроксена , пироксикама), что вело к ослаблению их эффекта. Во-вторых, возрастает опасность развития нежелательных реакций. Исключением является возможность назначения парацетамола в сочетании с НПВП для усиления аналгетического эффекта. При применении НПВП отмечается высокий риск развития нежелательных реакций со стороны ЖКТ, в частности характерно развитие специфического синдрома – НПВП-гастропатии, связанного не столько с локальным повреждающим влиянием НПВП (большинство из них – органические кислоты) на слизистую оболочку желудка, но в основном обусловленного системным действием препаратов. Поэтому НПВП-гастропатия может развиваться не только при приеме внутрь, но и при парентеральном или ректальном введении НПВП. Чаще всего имеет место повреждение слизистой ЖКТ в антральном и препилорическом отделе желудка (эритема слизистой оболочки, эрозии, язвы, кровоизлияния).
К факторам риска НПВП-гастропатии относят:
- пожилой возраст (риск развития язвенных поражений желудка у таких пациентов в 4 раза выше, чем у молодых людей);
- женский пол (НПВП-гастропатия у женщин встречается в 2–3 раза чаще, чем у мужчин);
- предшествующие и сопутствующие заболевания (язвенная болезнь, пептическая язва, цирроз печени, заболевания сердечно-сосудистой системы);
- одновременный прием других препаратов (антикоагулянтов, иммуносупрессантов, глюкокортикостероидов, длительная терапия НПВП, особенно их прием в больших дозах и/или одновременный прием двух или более препаратов этой группы);
- курение (особенно при наличии язвенной болезни в анамнезе);
- употребление алкоголя (данный фактор повышает риск возникновения желудочно-кишечных кровотечений более чем в 2 раза);
- носительство Helicobacter pylori.
Наличие одновременно нескольких факторов риска значительно увеличивает вероятность развития НПВП-гастропатии и ее осложнений. Частота возникновения НПВП-гастропатии наиболее высока в 1-й месяц лечения, затем она постепенно снижается и остается стабильной, начиная с 4-го месяца лечения. При непрерывном применении НПВП на протяжении 6 мес, как показали эндоскопические исследования, только у 32% пациентов слизистая желудка остается в норме. У остальных 68% больных выявляются те или иные патологические изменения в слизистой оболочке. Язвы, вызванные приемом НПВП, нередко протекают бессимптомно (особенно у пожилых пациентов), и диагноз во многих случаях устанавливают при фиброгастродуоденоскопии (ФГДС). Наиболее перспективны в профилактике НПВП-гастропатии синтетические аналоги ПГ, которые можно рассматривать в качестве средств заместительной терапии. Для профилактики эрозивно-язвенных поражений слизистой оболочки желудка применяют мизопростол. Препарат тормозит не только секрецию соляной кислоты, но и оказывает цитопротективное действие, стимулируя образование слизи и бикарбоната. Мизопростол в дозе 200 мкг 4 раза в сутки существенно снижает частоту изъязвлений слизистой оболочки желудка у больных, длительно принимавших НПВП. В настоящее время имеется комбинированный препарат Артротек, в состав которого входит диклофенак (50 мг) и мизопростол (200 мкг).
Лечение НПВП-гастропатии включает в себя применение в течение 4–8 нед блокаторов протонного насоса (омепразол, пантопразол, эзомепразол, лансопразол) в стандартных дозах, а в осложненных случаях (например, при желудочно-кишечных кровотечениях, трудно рубцуюшихся язвах) – удвоенных.
Для снижения гастротоксичности НПВП возможно использование НПВП в виде пролекарств. В частности, сулиндак не обладает противовоспалительной активностью, но в результате биотрансформации в печени превращается в активные метаболиты, теряя способность накапливаться в кардиальном отделе желудка. Улучшение переносимости НПВП может быть достигнуто и путем изменения тактики их применения, в частности, снижения разовой и суточной доз препарата, т.е. использование минимальных терапевтических (эффективных) доз. С целью уменьшения вероятности развития системных побочных эффектов НПВП, прежде всего НПВП-гастропатии, возможно местное применение НПВП в виде мази, крема, геля. Применение этих лекарственных форм может успешно сочетаться с энтеральным или парентеральным введением НПВП.
В комплексной терапии урогенитальных артритов широко применяется локальная терапия диметилсульфоксидом (ДМСО). Клиническая эффективность ДМСО обусловлена наличием у него противомикробного, противовоспалительного, а также иммуномодулирующего действия. ДМСО проявляет высокую активность в отношении различных возбудителей урогенитальных инфекций, в том числе хламидий и уреаплазм. В гинекологической практике он применяется для лечения хламидийных цервицитов и вагинитов. Аппликации 30-50% раствора ДМСО способствуют обратному развитию экссудативных проявлений в суставах. Обладая высокой проникающей способностью, ДМСО оказывает антимикробное действие на персистирующую хламидийную инфекцию и используется в качестве проводника для других лекарственных средств – НПВП, ГКС, базисных препаратов. В ревматологической практике применяются мазевые формы, гели, содержащие ДМСО (Раумабен). Для лечения синовитов и артритов используют 50% ДМСО в виде компрессов, которые ставят на больные суставы на 30-50 минут.
Глюкокортикостероиды (ГКС) назначаются только при высокой активности воспалительного процесса и недостаточной эффективности НПВП. Энтеральный прием ГКС показан лишь при наличии системных поражений, таких как кардит, менингоэнцефалит, полиневрит. Препарат выбора – преднизолон, который вводят по 150 мг внутривенно капельно ежедневно в течение 5-10 дней. Вместо преднизолона в ряде случаев применяется дипростан внутримышечно по 1.0 мл 1 раз в 2 недели. Назначение преднизолона внутрь по 20-30 мг в сутки оправдано только коротким курсом 10-15 дней с постепенной отменой препарата. Длительный прием преднизолона и других ГКС противопоказан при РеА, так как он может способствовать хронизации процесса и прогрессированию заболевания. При тяжелом течении РеА с высокой клинической и лабораторной активностью рекомендуется пульс-терапия метилпреднизолоном внутривенно капельно по 500-1000 мг в течение 3 дней подряд. Пульс-терапия эффективно купирует активность РеА и в большинстве случаев хорошо переносится больными. Однако предпочтительнее вводить ГКС локально. Для быстрого купирования воспалительного процесса в суставах и околосуставных тканях нередко используют внутрисуставное или периартикулярное введение гидрокортизона, метилпреднизолона (Метипред), бетаметазона (Дипроспан), триамцинолона (Кеналог). Однако следует помнить, что длительное применение ГКС может способствовать персистенции инфекционного агента и приводить к суставной деструкции вследствие отрицательного воздействия гормонов на метаболизм внутрисуставного хряща.
При хроническом, рецидивирующем течении РеА, наличии внесуставных проявлений РеА показано назначение базисных средств, которые используются для лечения ревматоидного артрита. К базисным противоревматическим препаратам относятся: 1) аминохинолиновые препараты – делагил, плаквенил; 2) сульфаниламиды – сульфасалазин, салазопиридазин; 3)препараты золота – кризанол, ауранофин, тауредон; 4) иммунодепрессанты – азатиоприн, метотрексат. Большинство зарубежных исследователей считает, что базисную терапию артритов целесообразно начинать с сульфасалазина, который применяется в случаях отсутствия эффекта от симптоматической терапии. Обычно применяется следующая схема лечения: 1-я неделя – 0,5 г в сутки; 2-я неделя – 1 г в сутки; 3-я неделя – 1.5 г в сутки; 4-я неделя – 2 г в сутки. Максимальная доза 300 мг в сутки – в первые 3 месяца терапии, затем дозу снижают до 1.5-2 г в сутки, продолжительность лечения – 6-18 месяцев до достижения клинического эффекта. Показано, что применение сульфасалазина снижает признаки воспаления периферических суставов, однако не влияет на прогрессирование артрита. Результаты плацебо-контролируемых исследований противоречивы. В процессе лечения необходимо проведение контроля уровня тромбоцитов, лейкоцитов, эритроцитов для исключения развития лейкопении и нейтропении, а также активности трансаминаз, щелочной фосфатазы и билирубина – возможно развитие лекарственного гепатита с синдромом холестаза. В случае плохой переносимости или развития осложнений сульфасалазин следует отменить. Метотрексат, азатиоприн, хлорамбуцил или циклофосфамид применяют по тем же показаниям, что и сульфасалазин. Метотрексат назначают внутрь в дозе 10-15 мг в неделю; суточная доза азатиоприна -100-150 мг, хлорамбуцила – 4-6 мг. Циклофосфамид вводят внутримышечно или внутривенно по 200 мг 2-3 раза в неделю или назначают для приема внутрь в дозе 100-150 мг в сутки. Однако контролируемых исследований оценки эффективности этих препаратов при РеА не проводилось, и достоверные данные их эффективности отсутствуют. Цитостатики, обладая иммунодепрессивным эффектом, вызывают большое количество побочных эффектов и осложнений. В частности, угнетают кроветворение, вызывая развитие тромбоцитопении, лейкопении, нейтропении и апластической анемии. Нередко провоцируют различные инфекционные осложнения, обладают гепатотоксическим действием. Поэтому на фоне приема цитостатиков необходим регулярный контроль картины периферической крови (1 раз в неделю), исследование маркеров печеночного цитолиза – трансаминаз (1 раз в 2 недели). Цитостатики противопоказаны при беременности, так как вызывают хромосомные аберрации и врожденные пороки развития.
Важную роль в лечении суставного синдрома играют физиотерапевтические методы, лечебная физкультура, массаж, санаторно-курортное лечение.
Литература
- Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. Издание 2-е исправленное и дополненное. М.: Универсум Паблишинг, 1997.
- Бельгов А.Ю.Реактивные артриты: диагностика и лечение. Лечебное дело, 2009, №2
- Бертман Г., Катцунг Базисная и клиническая фармакология. Т. 1, 2. М.: Бином, 1998.
- Дятчина Л.И., Борщев П.М., Телеснин Е.А. Клиническая фармакология нестероидных противовоспалительных средств и рациональная тактика их применения. Ростов-на-Дону, 2009.
- Ивашкин В. Т., Шептулин А.А.Влияние анальгетиков на слизистую оболочку желудка и состояние печени. Клиническая фармакология и терапия. 2003; 12 (1).
- Кукес В.Г. Клиническая фармакология. М.: ГЭОТАР-Медиа, 2004.
- Кукес В.Г., Сычев Д.А. Клиническая фармакология ненаркотических анальгетиков. Клиническая фармакология и терапия. 2002; 11 (5).
- Лебедева Р.П., Николаев В.В. Фармакотерапия острой боли. М., 1998.
- Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология: В 2 томах. Т. 1, 2. М.: Медицина, 1993.
10. Машковский М.Д. Лекарственные средства: В 2 томах. 14-е издание. М.: Новая Волна, 2000.
11. Рациональная фармакотерапия ревматических заболеваний. Руководство для практикующих врачей. Под общ. ред. В.А. Насоновой, Е.Л. Насонова. М.: Литтерра, 2003.
12. Справочник Видаль. Лекарственные препараты в России. М.: АсграФармСервис, 2011.
13. Цегла Т. Лечение боли: (Цегла Томас, Андре Готтшальк)-2-е издание. М.:МЕДпресс-информ,2001.-384 с.
14. Федеральное руководство для врачей по использованию лекарственных средств (Формулярная система). М., 2000.
Артрит — распространенная форма заболевания суставов. Это частый диагноз, врачи классифицировали болезнь на несколько групп. Существует воспалительный тип, связанный с внутренним функционированием двигательной системы, инфекционный – связанный с попаданием в организм инфекций.
Относится к инфекционным. В названии заключена природа: возникает в качестве реакции на изменение организма, чаще – инфекционное. Инфекция попадает в организм, распространяется по организму, вызывает в системах новые заболевания, осложнения. Причины различаются в зависимости от пути проникновения бактерий, вызвавших проблемы.
Лечение ориентируется на избавление от инфекции, потом врачи обращают внимание на реактивное заболевание, воспаления внутренних органов. Назначаются антибактериальные средства — Метотротексат, Сульфасалазин для соединительных тканей. Затем начинается реабилитационный курс, гимнастика, прочие процедуры на возвращение ногам прочности, гибкости. Сульфасалазин – противовоспалительное средство, угнетающее иммунитет, как антибиотики. Угнетение иммунитета необходимо для борьбы с бактериями, ставшими главными причинами заболевания.
Основная группа риска – люди в возрасте 20 — 40 лет. Реактивный артрит чаще поражает суставы ноги:
- Голеностопные;
- Коленные;
- Боли в пятках;
- Мелкие суставы стоп.
Поражение проходит асимметрично. При инфицировании коленей, будет поражено одно колено, не оба. Исключительные случаи поражения обоих колен – патология.
![]()
Причины возникновения
Осложнение наступает во время, после протекания инфекции. Вылечить инфекцию не значит, что реактивный артрит не наступит.
Врачи с трудом находят объяснение тому, что болезнь возникает чаще при особой генетической структуре организма. Имеется версия, что реактивный артрит поражает людей, в организме которых присутствует особый генетический код HLA B 27. Связан код с аутоиммунными реакциями, часто причины заболевания затрагивают его тоже. Он не вызывает конкретные боли, его воздействие происходит внутри, незаметно для внешних признаков человека.
Чаще инфекция, способная вызвать реактивный артрит, попадает в организм через органы:
- Носоглотка (ОРЗ);
- Половые органы (хламидиоз, гонорея);
- Элементы желудочно-кишечного тракта (пищевые отравления, кишечные бактерии).

Перечень инфекционных заболеваний, способных вызвать реактивный артрит, можно увидеть в списке классов МКБ 10. МКБ («Международный Класс Болезней»). Сейчас действуют классы, классифицированные при 10 пересмотре. В качестве группы инфекций, представляющих риск для организма заболеть другими воспалительными болезнями, помимо полученного урона, можно рассматривать 1 класс: заключает много инфекций.
Не связано с тем, что вредоносные бактерии попадают в сустав. Инфекция выступает в качестве пускового рычага, триггера: если во время инфекции возникают осложнения, боли в местах, не связанных с инфекцией, значит организм реагирует на собственное инфицирование. Причины в том, что сбивается работа иммунитета, заболевания имеют хорошую среду для зарождения, развития.
Существует версия, что главная причина заболевания – инфекционные микроорганизмы, поступающие в организм человека, обладают такими же веществами, что антитела, с которыми иммунная система привыкла бороться. Из-за того, что она не может разобраться, где среди антител враг, где друг, начинается воспаление: иммунитет предпочел напасть на суставы. Больному назначается Сульфасалазин.
Симптомы
Заболевание, возникающее во время инфекции, проявляет свойства через 2-4 недели после инфицирования. Проявляется посредством яркого выражения симптомов.
Симптомы реактивного артрита различаются в зависимости от характера инфекции. В случае с половой инфекцией (заражением хламидиозом через половой контакт) симптомы инфекции часто не проявляются, если проявляются, то выражаются через простые боли, возникновение проблем с мочеиспусканием, несвойственным выделением из половых органов.
Часто симптомы реактивного артрита перевешивают инфекционные, выражаются резко. Существует три классических симптома, по которым распознают заболевание:
- Воспаление суставов: боли, покраснение кожи в области сустава, повышенная отечность, утренняя скованность, затрудненное передвижение;
- Воспаление глаз: обильное течение слёз, жжение в глазах, конъюнктивит;
- Воспаление мочевыводящих путей: уретрит, боли при мочеиспускании, неприятные ощущения в промежности, повышенный вывод мочи из организма (подразумевается частота походов в туалет).

Симптомы реактивного артрита затрагивают несколько систем, внутренних органов. Связано это не с тем, что вредоносные микроорганизмы распространяются по организму, поражают всё, а с тем, что они служат триггером для развития новых заболеваний. Их причины в случае массового, одновременного возникновения, будут если не одинаковыми, то родственными. Если врачом не поставлен диагноз (из-за чего лечение подторможено), то возникновение воспалений укажет специалисту на возможный реактивный артрит.
Воспаления других органов — глаза, мочеиспускательная система, выражаются слабо, часто теряются на фоне общего самочувствия. Причины заключаются в том, что боль не имеет острый характер, бывает списана на простое раздражение. Часто так и бывает, поэтому стоит рассматривать возникновение заболевания в комплексе.
Помимо симптомов, связанных с другими органами, реактивный артрит можно распознать по другим симптомам. Наличие симптомов значит, что существует риск заболевания , его существование.
- Повышенный острый болевой синдром суставов;
- Высокая вероятность возникновения отёков;
- Повышенная температура тела;
- Скованность в движениях;
- Возникновение на коже ладоней, стоп своеобразных пузырьков, заполняющихся кровью – это не гной, отмершая кожа;
- Ухудшение общего самочувствия.
По мере течения реактивного артрита, начавшегося с одного сустава, поражаются и другие: осуществляется приём базовых лекарств — Сульфасалазин, Метротексат.
Любой артрит – болезнь опасная, быстро прогрессирующая. Если чувствуете, что боли в ногах носят воспалительный характер, стоит срочно обратиться к врачу. Времени это много не займёт, сможете обезопасить себя как минимум от инвалидности.
может быть у детей и стариков. При болезни Крона суставные проявления обычно возникают в детском и юношеском возрасте. Развитие периферического артрита при этих заболеваниях обычно не ассоциируется с носительством антигена гистосовместимости В27.
Анкилозирующий спондилоартрит чаще наблюдается у мужчин, чем у женщин (3:1). Это заболевание обычно развивается у лиц, у которых выявляется HLA В27.
Суставные изменения при неспецифическом язвенном колите и регионарном илеите чаще возникают у больных с другими вне-кишечными проявлениями процессов - при язвах слизистой оболочки ротовой полости, увейте, узловатой эритеме, гангренозно» пиодермии.
Клиника. Клиническая картина периферического артрита характеризуется острыми атаками, рецидивами. Обычно их развитие совпадает с обострением основного заболевания. Последнее чаще всего за несколько лет предшествует появлению периферического артрита, но иногда артрит является первым признаком кишечного заболевания. Суставные проявления - припухлость, болезненность, гипертермия кожных покровов над суставом, выпот в синовиальной полости воспалительного характера. При каждой атаке поражается обычно не более трех суставов, причем процесс может быть мигрирующим, чаще охватывающим коленные и голеностопные суставы; мелкие суставы кистей и стоп поражаются редко. Длительность атаки составляет от одного до нескольких месяцев. При многократном рецидивировании могут возникнуть стойкие суставные дефигурации, что служит основанием для дифференциальной диагностики с РА, особенно его серонегативным вариантом. Могут быть только артралгии.
Лабораторные исследования. Лабораторные показатели отражают главным образом активность кишечного процесса. Выявляют увеличение СОЭ, умеренную анемию. РФ обнаруживается не чаще, чем в общей популяции. Рентгенологические данные непоказательны.
При лечении суставного синдрома бывает достаточно назначить нестероидные противовоспалительные средства, изредка - внутрисуставные инъекции ГКС. Препараты золота противопоказаны.
Основное внимание должно быть направлено на лечение кишечного процесса (сульфасалазин, салазопиридазин и др.).
Анкилозирующий спондилоартрит при неспецифическом язвенном колите и регионарном илеите встречается в 5-7 % случаев и по клиникорентгенологической симптоматике ничем не отличается от болезни Бехтерева. Его выявление чаще всего предшествует клинике кишечного поражения. Лечение последнего не приостанавливает дальнейшего развития анкилозирующих изменении в позвоночнике. Терапевтические мероприятия не отличаются от тех, которые рекомендуются при болезни Бехтерева.
АРТРИТЫ, СВЯЗАННЫЕ С ИНФЕКЦИЕЙ
К этой группе артритов относятся заболевания суставов, при которых четко прослеживается или с высокой долей вероятности предполагается связь развития суставного поражения с определенным инфекционным началом (микроб, вирус, гриб и пр.). Суставной синдром в виде артралгии или преходящего артрита (полиартрита) может по существу сопровождать любое инфекционное заболевание, особенно в остром, лихорадочном периоде. В таких случаях поражение суставов выступает как второстепенный, дополнительный признак обще-
го заболевания, по поводу которого больной лечится у специалистов - инфекционистов. Говоря же об артритах, связанных с инфекцией, как об одной из основных групп РБ суставов, мы предполагаем такую ситуацию, когда обусловленная инфекцией суставная симптоматика является самостоятельным процессом. Это может иметь место главным образом в тех случаях, когда острая фаза инфекционного заболевания была кратковременной, со скудной клинической симптоматикой или протекала скрыто, а развившийся артрит, особенно принявший затяжное и даже хроническое течение, стал определяющим во всей клинической картине болезни. В таких условиях могут возникать значительные трудности при дифференциальной диагностике инфекционного артрита с другими воспалительными заболеваниями суставов.
Входными воротами инфекции при артритах чаще всего бывают носоглотка, мочеполовые органы и кишечник . Все заболевания суставов описываемой группы подразделяются на инфекционные и реактивные артриты. Инфекционные артриты возникают преимущественно вследствие гематогенного метастазирования инфекции из первичного очага в ткани сустава, в том числе в синовиальную оболочку. В ответ развивается воспалительный процесс, обусловленный на первых этапах действием самого инфекционного начала и его токсинов. Внешний агент непосредственно может активизировать важнейшие и наиболее ранние факторы борьбы организма с инфекцией - систему комплемента и фагоцитоз. В норме быстро наступает элиминация чужеродной субстанции и минимальное повреждение тканей. При нарушении защитных реакций макроорганизма, например, при снижении ответа нейтрофилов на хемотаксический стимул, ослаблении функции фагоцитов, при иммунодефицитных состояниях (первичных или вторичных), при массивной инфекции или неадекватном применении антибиотиков, способствующем превращению микробов в устойчивые формы, этого может не произойти. Триггерный агент или его остатки, (антигены) надолго сохраняются в суставных тканях (связках, хряще, макрофагах и пр.), обусловливая развитие иммунокомплексного процесса.
Реактивные артриты - «стерильные» воспалительные заболевания суставов, возникающие в тесной временной (1-1,5 мес) связи с какой-либо определенной инфекцией. Типичные реактивные артриты-ревматический (стрептококковый), обусловленный иерсиниями, шигеллами, сальмонеллами, клебсиеллами, кампилобактериями, эшерихиями, артрит при шаровидных угрях, менингококковой септицемии и др. Некоторые из реактивных артритов (например, при кишечных инфекциях) можно отнести к числу заболеваний, ассоциирующихся с HLA B27, при них иногда развивается клиника болезни Рейтера. Другие же реактивные артриты (например, стрептококковый, менингококковый) не имеют общей генетической связи.
Патогенез реактивных артритов до конца не выяснен. Одним из возможных механизмов их развития считается чрезмерный иммунный ответ макроорганизма на микробные антигены, находящиеся вне полости сустава, с формированием иммунных комплексов, отложением их в синовиальной оболочке, что обусловливает развитие иммунокомплексного синовита. Р. С. Dumonde (1979) среди артритов, сочетающихся с инфекцией, выделяет инфекционные, постинфекционные, реактивные и воспалительные в зависимости от того, насколько известен при них этиологический фактор, удается ли его или его антигены изолировать из полости сустава. Следует иметь в виду, что такое подразделение условно, поскольку многое зависит от технических возможностей идентификации инфекционного начала, которые совершенствуются с каждым годом.
Острый инфекционный артрит (септический, гнойный) - поражение сустава, обусловленное прямым попаданием микроорганизмов в его полость из каких-либо первичных очагов или при открытой травме (проколе) сустава. Этиологическими факторами могут быть разнообразные микробы, но на первом месте стоят стафилококковая (Staphylococcus epidermidis et aureus), стрептококковая (гемолитический стрептококк группы А, зеленящий стреп-
тококк) инфекция и грамотрицательные микробы (Escherichia coli, Proteus vulgaris, Klebsiella
pneumoniae, Pseu-domonas pseudomallei, Aeromonas hydrofhila). Инфекционный артрит иногда может быть вызван и прямой инвазией в сустав таких микроорганизмов, как шигеллы, сальмонеллы, иерсинии.
Острый инфекционный артрит может возникнуть на фоне фурункулеза, перитонзиллярного абсцесса, ангины, скарлатины, воспаления среднего уха, пневмонии, инфекционного эндокардита, при инфицированных ранах любой локализации, после цистоскопии, операций на органах брюшной полости и мочеполовой системы и пр. Иногда первичный очаг выявить не удается. К развитию инфекционного артрита предрасположены старики, лица, ослабленные такими общими заболеваниями, как болезни крови, злокачественные опухоли, PA, СКВ, особенно если они находились на длительной кортикостероидной или иммунодепрессивной терапии, а также недоношенные дети и алкоголики.
Как видно из изложенного, во всех этих случаях речь идет о развитии первичного или вторичного иммунодефицита.
Клиника. В большинстве случаев поражаются один или два сустава. Артрит начинается остро с резчайших болей, припухлости сустава, гиперемии и гипертермии его, лишь иногда этим явлениям за несколько дней предшествует мигрирующая полиартралгия. Одновременно с развитием суставного синдрома наблюдаются лихорадка гектического типа, ознобы, проливные поты. В крови выявляют лейкоцитоз с выраженным сдвигом лейкоцитарной формулы влево, увеличение СОЭ и другие показатели воспалительной активности. У пожилых и крайне ослабленных больных артрит может начаться постепенно, проявляясь умеренными общими и местными признаками воспаления и приобретая хроническое течение. Чаще всего поражаются коленные и тазобедренные суставы (обычно у детей), а также плечевые, локтевые, лучезапястные, голеностопные суставы, позвоночник и илеосакральные сочленения.
При исследовании синовиальной жидкости обнаруживают высокий цитоз (20·109 /мл) с преобладанием (до 90%) нейтрофилов. Жидкость мутная, вязкость ее снижена, муциновый сгусток рыхлый, распадающийся, в ней обнаруживаются микроорганизмы. На самых ранних стадиях болезни синовиальная жидкость порой не имеет гнойного характера, и требуются ее повторные аспирации для получения информативных результатов.
Рентгенологически очень рано выявляют эпифизарный остеопороз, сужение суставной щели, а при неадекватном лечении такой характерный для инфекционного артрита признак, как быстрое развитие под влиянием протеолитических ферментов гноя, деструктивных изменений не только хряща, но и костного остова сустава. Исходом заболевания может быть вторичный деформирующий остеоартроз, который с годами прогрессирует, или костный анкилоз пораженного сустава.
Диагноз. Диагностика болезни бывает несвоевременной, так как на ранних стадиях острого гнойного артрита его принимают за травматический артрит, приступ подагры, ревматизм, РА и пр. Важно учитывать наличие ознобов, размахи температуры, неправильный тип лихорадки, лейкоцитоз. Необходимо стремиться к этиологической диагностике процесса. Ориентировочный диагноз можно поставить при просмотре окрашенных по методу Грама мазков синовиальной жидкости, а окончательный - при выделении культуры микроорганизма из крови или синовиального выпота.
Лечение. Необходима иммобилизация конечности в положении разгибания на короткий срок (1-2 нед); при улучшении состояния больного приступают к активной разработке движений в суставе.
Основу терапии составляют антибиотики, которые следует назначать по возможности с учетом чувствительности к ним микробной флоры. При стрептококковой и стафилококковой инфекции используют пенициллин по 250000 ЕД/(кг·сут), в среднем для взрослых 12000000-20000000 ЕД внутривенно, распределив дозу на 4 введения. Длительность тера-
пии индивидуальна - 3-6 нед. Можно применять и антибиотики широкого спектра действия, например, цепорин по 60-100 мг/(кг·сут) в 2-3 приема.
При грамотрицательной кишечной флоре показан гентамицин в дозе 3 мг/(кгсут), распределенной на 3 приема. Лечение проводят в течение 2-3 нед, заменяя гентамицин на ампициллин (6-10 г/сут в 4-6 приемов) или цепорин.
Показан ежедневный дренаж сустава: аспирация гноя через широкую иглу и внутрисуставное введение антибиотиков. Дренаж сустава осуществляют до тех пор, пока синовиальная жидкость не станет чистой.
Положительный результат такой консервативной терапии в большинстве случаев должен быть получен уже к концу первой недели, однако активная терапия должна продолжаться до полного излечения. В тех случаях, когда микроорганизм, обусловившей развитие артрита, устойчив к антибиотикам, санация сустава затруднена, если через 2-3 нед терапии не отмечается стойкого улучшения и нарастает риск развития деструктивных изменений в суставе, прибегают к хирургическому дренажу. Последний особенно показан у детей с поражением тазобедренных суставов. При наступившей деструкции сустава необходимо удалить хирургическим путем некротизированные фрагменты и очаги инфекции в мягких периартикулярных тканях. Все больные с инфекционным артритом подлежат наблюдению и лечению у хирургов-ортопедов.
Гонококковый артрит встречается в 0,08-0,6 % случаев осложненной гонореи [Ильин И. И., 1976]. Чаще болеют женщины, в том числе девочки, страдающие гонококковым вульвовагинитом. Мужчины заболевают крайне редко в связи с быстрым излечением уретрита. Исключение составляют гомосексуалисты, болеющие гонококковым проктитом.
Этиология и патогенез. Возбудителем заболевания является гонококк, который проникает в полость сустава гематогенным путем, метастазируя из первичного урогенитального очага. Такая возможность создается при диссеминированной (генерализованной) гонорее, которая наблюдается примерно у 1 % мужчин и у 4 % женщин. Большая частота и тяжесть заболевания у женщин объясняется нередко бессимптомным течением первичной инфекции, поздним ее распознаванием и слишком поздним лечением. Предрасполагающими факторами у женщин являются также беременность и менструация, в течение которых в половых органах создаются благоприятные условия для размножения гонококка . Возможность развития у больных гонореей реактивного артрита берется многими авторами под сомнение, поскольку выяснилось, что в прошлом за артрит такого генеза принимали венерическую форму болезни Рейтера [Торсуев Н. А. и др., 1975; Aho К. et al., 1976].
Клиника. Истинный гонококковый артрит характеризуется теми же симптомами, что и любой другой септический суставной процесс: высокой лихорадкой, ознобами, поражением одного или нескольких суставов, лейкоцитозом. Обычная локализация процесса - коленные, голеностопные, лучезапястные суставы, в которых резко выражены признаки местного воспаления и быстро развивается атрофия околосуставных групп мышц. Крайне редко развитие гонококкового моноили олигоартрита не сопровождается общими симптомами сепсиса. У 25-50 % больных одновременно обнаруживается гонококковое поражение кожи в виде узелковых папул на красном основании, иногда везикул и пустул, наполненных гнойным или геморрагическим содержимым с темным некротическим центром, которые локализуются обычно на спине, дистальных отделах конечностей, вокруг суставов . Гонококковая этиология суставного процесса может рассматриваться как вероятная, если микроорганизм обнаружен только в аногенитальных очагах, но адекватная пенициллинотерапия приносит быстрый и полный эффект.
Реакция Борде - Жангу имеет лишь вспомогательное диагностическое значение, так как при острой гонорее она становится положительной лишь на 2-4-й неделе заболевания. Однако при хронической осложненной гонорее (эпидидимиты, сальпингоофориты, простатиты и пр.) положительна в 40-90 % случаев. Результаты реакции могут быть приняты во внимание при неясных формах суставной патологии, особенно у женщин с хроническими воспалительными очагами мочеполовых путей.
Дифференциальный диагноз. Острый гонококковый артрит, особенно при отсутствии убедительных доказательств связи его с гонореей, следует дифференцировать от других инфекционных артритов. При этом следует принимать во внимание, что гонококковый артрит возникает, как правило, у практически здоровых людей, в то время как иные инфекционные артриты - чаще у ослабленных больных, на фоне тяжелых общих заболеваний. Болезнь Рейтера в отличие от гонококкового артрита преимущественно диагностируется у мужчин, являющихся носителями HLA B27; ее развитие находится в хронологической связи с негонококковым (чаще всего хламидийным) уретритом или простатитом, а клиническая симптоматика, помимо артрита, включает такие признаки, как конъюнктивит, баланит, поражение слизистых оболочек полости рта, кератодермия подошв и ладоней.
Лечение. В остром периоде - покой, создание удобного положения для пораженной конечности с помощью подушек, валиков, шин, сухое тепло на сустав. Обязательно назначается пенициллин по 6000000-10000000 ЕД/сут 4 раза. Если диагноз установлен своевременно и лечение начато рано, уже через 1-3 дня может наступить поразительно быстрое обратное развитие всех клинических проявлений заболевания, что рекомендуется учитывать как дополнительный диагностический признак гонококкового артрита. Лечение пенициллином продолжают в течение 7-14 дней, иногда заменяя его по мере улучшения состояния на ампициллин в дозе 2 г/сут. Можно также использовать эритромицин по 1,5-2 г/сут в течение 1-2 нед. При истинном гонококковом артрите оказывается достаточно эффективной кратковременная антибиотикотерапия. Кроме пенициллина, назначают НПВП (индоцид, реопирин, бутадион, вольтарен и др.). Крайне редко при выраженном болевом синдроме в остром периоде допустимо применение более мощных анальгетиков (промедол и др.). При стихании воспалительных явлений назначают массаж, лечебную гимнастику, физиотерапевтические процедуры (соллюкс, диатермия, парафиновые аппликации).
Б р у ц е л л е з н ы й а р т р и т . Бруцеллез - хроническое инфекционное забо-
левание, вызываемое микроорганизмами Brucella melitensis, Brucella abortus, Brucella suis.
Источником заражения являются козы, овцы, крупный рогатый скот, свиньи. Заболевание у человека возникает преимущественно при употреблении в пищу молочных продуктов (сыр, творог, молоко) или при непосредственном контакте с больными животными. Микроорганизм имеет склонность задерживаться в тканях, богатых ретикулоэндотелием (костный мозг, лимфатические узлы, печень, селезенка), где развиваются специфические гранулематозные инфильтраты. Последние имеют и другую излюбленную локализацию - рыхлая соединительная ткань вокруг суставов, наружные слои капсулы, слизистые сумки, связки, сухожилия, - что ведет к появлению плотных, не нагнаивающихся образований - фиброзитов. Метастатическое поражение костно-хрящевого остова сустава и истинный бруцеллез-
ный синовит встречаются крайне редко - всего у 2-7 % больных [Касаткина И. Л., Беклемишев Н. Д., 1976]. Более часты, по-видимому, артриты реактивного типа.
Опорно-двигательный аппарат вовлекается в процесс преимущественно у людей старше 50 лет.
Клиника. Бруцеллез протекает остро, подостро, хронически, причем в последние годы число хронических случаев значительно увеличилось они составляют 51-69 % среди больных стационара [Дорошенко К. Т., Рогозенко Г. Ф., 1975]. Встречаются и первичнохронические формы процесса (14 % случаев) [Амиркулов И. М., 1979], которые нередко представляют значительные диагностические трудности. Болезнь проявляется волнообразной лихорадкой, ознобами, проливными потами, увеличением лимфатических узлов, печени, селезенки, изменениями нервной системы (головная боль, психические расстройства, невриты и др.) и других органов и систем. Клинико-рентгенологические признаки поражения ко- стно-суставного аппарата появляются либо в начальном периоде бруцеллезной инфекции (уже в первые 3 нед), либо на протяжении года от начала заболевания и чаще (в 45 % случаев) при хронических формах болезни. Отмечаются генерализованные артралгии в периферических суставах, крестце, позвоночнике (чаще у мужчин). Бруцеллезный спондилит характеризуется преимущественным поражением III-IV поясничных позвонков, затем грудного отдела, и реже всего процесс затрагивает шейный отдел; нередко развивается сакроилеит.
На первый план выступают сильные боли в спине, особенно выраженные при надавливании на остистые отростки пораженных позвонков и илеосакральные сочленения, и ограничение функции позвоночника. В подкожной клетчатке поясничной области нередко пальпируются резко болезненные узелки (фиброзиты). Часты также периартриты, бурситы, тендовагиниты, лигаментиты. Периартриты обычно возникают в области плечевых и тазобедренных суставов, пяточных костей и могут приводить к очаговому обызвествлению тканей.
Мелкие периферические суставы практически не поражаются. Выпот в суставной полости и деструкцию костного остова сустава можно наблюдать лишь изредка и преимущественно в коленных и локтевых суставах. При пункции этих суставов можно получить серознофиброзную жидкость, которая иногда содержит бруцеллы.
Из лабораторных показателей следует отметить лейкопению с лимфоцитозом. У больных обычно бывают положительными кожная проба с бруцеллезным антигеном (реакция Бюрне), опсонофагоцитарная реакция, а также серологические тесты (реакции Райта, Хеддлсона) в высоком титре (не менее 1:200). Иногда удается получить культуру микроба из крови или костного мозга.
Рентгенологическая картина при бруцеллезе либо не дает никакой информации, либо является неспецифической (выявляется остеопороз). Из характерных рентгенологических находок самой частой, по мнению многих рентгенологов, является сакроилеит. Может иметь место изолированное, одностороннее, но чаще двустороннее поражение. Вдоль суставной щели в костной ткани появляются один или несколько округлых небольших деструктивных очажков, сливающихся друг с другом; суставная щель становится изъеденной, затем суживается, и наступает полный анкилоз. Деструктивный специфический процесс может охватывать 1-4 позвонка и межпозвонковые диски, но в отличие от туберкулезного поражения не вызывает полного коллапса тел позвонков, разрушения межпозвонковых дисков и костного слияния смежных пораженных позвонков. На ограниченных участках позвоночного столба могут возникать бруцеллезные спондилоартриты с образованием грубых асимметричных сращений между пораженными позвонками, что отличает их от распространенного симметричного процесса при болезни Бехтерева. Деструктивные изменения в тазобедренных, коленных, локтевых суставах могут завершиться анкилозированием. Характерно для бруцеллеза развитие пяточных шпор, костных разрастании в области локтевых суставов, у верхнего полюса надколенной чашечки.
Диагноз. Диагноз бруцеллезного поражения ставят на основании описанной клиникорентгенологической картины, особенно при появлении болей в спине, лихорадки у лиц, имеющих контакт с животными или употребляющих продукты животных, лимфаденопатии, спленомегалии, выделения микробов из крови или синовиальной жидкости, результатов серологических проб.
Лечение и профилактика. Борьба с заболеванием животных; консервирование, кипячение всех молочных продуктов. Для подавления инфекции назначают тетрациклин (до 2 г/сут), стрептомицин (1 г/сут) в течение 3 нед, аналгезирующие и антивоспалительные препараты - индометацин, реопирин и другие, в хронических случаях - вакцинотерапию, хотя
ее эффективность и невелика. При сильных болях в спине рекомендуется носить корсет.
Т у б е р к у л е з н ы й а р т р и т. Костно-суставной туберкулез - местное проявление общей хронической инфекции организма Mycobacterium tuberculosis. В течение последних десятилетий число больных с туберкулезным поражением костей и суставов значительно уменьшилось: они составляют не более 1 % среди всех больных этой инфекцией
Знаменательным является «повзросление» туберкулеза вообще и туберкулеза с поражением опорно-двигательного аппарата в частности. Если раньше 4/5 всех больных костно-суставной патологией составляли дети в возрасте до 15 лет, то в настоящее время нередко этот процесс развивается у лиц в возрасте 60-80 лет.
Патогенез. При туберкулезе, как известно, первичный туберкулезный комплекс формируется в легких, откуда инфекция гематогенным или лимфогенным путем может диссеминировать в различные органы и ткани. В процессах ограничения или распространения инфекции играет определенную роль иммунный статус организма, в том числе нарушения клеточных факторов иммунного ответа, развитие гиперчувствительности замедленного типа. Специфическое поражение опорно-двигательного аппарата возникает и проявляется гораздо позднее, чем туберкулез других органов и систем, поскольку оно бывает обусловлено чаще всего реактивацией инфекции в первичном комплексе или метастазированием ее из очагов других внелегочных локализаций, но чаще всего из лимфатических узлов. Поражается преимущественно костная ткань: эпиметафизарные отделы длинных трубчатых костей, богатые красным костным мозгом позвонки, а также мелкие и короткие кости запястья, предплюсны, плюсны, фаланги пальцев и др. Развивается специфический остит (туберкулезный остеомиелит), который может быть относительно доброкачественным, медленно текущим, с преобладанием пролиферативных реакций (грануляционный, фунгилезный очаг) или более бурно протекающим, с развитием экссудативных и прогрессирующих деструктивных изменений (творожистый, казеозный остит).
Суставы вовлекаются в процесс в большинстве случаев последовательно, в результате распространения инфекции из костного очага на синовиальную оболочку и полость сустава, или же непосредственно - в холе лиссеминапии инфекции. Соответственно этому различают первично-костную форму туберкулезного поражения суставов, составляющую 80 % всех случаев, и первично-синовиальную, наиболее редкую. При первично-костной форме суставного туберкулеза происходит либо прорастание специфическими гранулематозными массами всех элементов сустава (синовиальной оболочки, капсулы, связок, хряща), либо прорыв в синовиальную полость костного очага, подвергшегося творожистому распаду, с образованием костной полости и костного секвестра. При первично-синовиальной форме в синовиальной оболочке формируются специфические туберкулезные бугорки, отмечается лимфоидная инфильтрация ткани, в полости сустава накапливается серозный выпот. Однако творожистого омертвения грануляций практически никогда не происходит. Специфические изменения постепенно распространяются на хрящ, вызывая его деструкцию, которая обычно начинается
с периферии и прогрессирует крайне медленно; одновременно процесс затрагивает и фиброзную капсулу сустава, и его связочный аппарат.
Клиника. Костно-суставной туберкулез у 50-60 % больных проявляется поражением периферических суставов и у 40-50 % больных - поражением позвоночника. Обычно имеют место изолированные изменения опорно-двигательного аппарата, множественные процессы наблюдаются крайне редко и преимущественно у детей. Общих проявлений, типичных, например, для легочного туберкулеза, - лихорадки, потливости, ознобов и др. - часто не отмечается. Лабораторные показатели воспалительной активности, включая СОЭ, в большинстве случаев не изменены. Активные туберкулезные очаги в легких при этом обнаруживаются всего у 10-50% больных, хотя могут быть выявлены со стороны других внутренних органов.
Туберкулез суставов у 85 % больных протекает в виде хронического моноартрита. Поражаются чаще суставы, несущие наибольшую нагрузку - тазобедренные, коленные, мелкие суставы стоп. Мужчины заболевают в 2 раза чаще, чем женщины. Период развития туберкулезного остита, до перехода процесса на сустав (преартритическая фаза), может быть клинически бессимптомным или проявляться непостоянными и небольшими болями в суставе, которые в ряде случаев появляются лишь при резких движениях. Эти боли могут не привлекать к себе внимания больного и за много лет предшествовать появлению клинических признаков суставного воспаления (артритическая фаза). В артритической фазе определяются отчетливая болезненность, припухлость и появление выпота в суставе. Функция сустава может быть ограниченной из-за болей, рефлекторных мышечных контрактур; выявляются хромота и мышечная атрофия, достигающая в процессе эволюции болезни значительной степени. Скопление значительного количества жидкости в полости сустава с одновременным отеком периартикулярных тканей и атрофией прилежащих мышц могут обусловить значительную дефигурацию сустава. В дальнешем вследствие прорастания полости сустава грануляциями, разрушения хряща и суставных отделов костей, их укорочения и смещения развивается деформация сустава. Абсцессы и свищи в области пораженных суставов в настоящее время встречаются лишь при запущенных формах заболевания.
Рентгенологически уже в преартритической фазе на фоне нормальной костной ткани или диффузного остеопороза может выявляться очаговая перестройка рисунка костных трабекул. В артритической фазе появляются краевые дефекты костей, в дальнейшем - ограниченная костная полость, иногда с наличием секвестра (особенно характерны так называемые «контактные секвестры»), сужение суставной щели при одновременной изъеденности контуров подхрящевой кости.
При туберкулезном поражении коленного сустава первым признаком является непостоянная и незначительная боль, существенно не влияющая на функцию сустава, затем (в ряде случаев лишь через несколько месяцев) появляется «водянка» сустава. При первичносиновиальной форме, которая в этом суставе, по-видимому, встречается чаще всего, оба признака могут возникать одновременно. Рентгенологически деструктивные изменения обычно локализуются в области мыщелков большеберцовой кости, где могут появляться краевые дефекты у мест прикрепления суставной сумки, напоминающие эрозии при ревматоидном артрите, реже - секвестрация в одном из мыщелков бедра, где обычно локализуется первичный костный фокус. Иногда решающие для диагноза рентгенологические изменения длительно не обнаруживаются, а затем неожиданно появляются на протяжении короткого срока.
Рис. 39. Туберкулез правого плечевого сустава - обширный бухтообразный дефект верхненаружного участка головки плечевой кости (по С. А. Рейнбергу).
В тазобедренном суставе преимущественно встречается первично-костная форма. Наиболее постоянный симптом - боль в паху, колене или бедре. Иррадиация болей осуществляется по запирательному нерву и его поднадколенным ветвям. У детей самым ранним симптомом может быть хромота. Часто имеется атрофия мышц ягодицы и бедра. При осмотре больного можно выявить также нарушение функции сустава; в положении на спине - сгибательную контрактуру и тенденцию к отведению бедра. Изредка при формировании «холодных» абсцессов можно выявить припухлость по передненаружной поверхности бедра, а в отдельных случаях и свищи. При рентгеновском исследовании деструктивные изменения чаще обнаруживаются в вертлужной впадине, а также в шейке бедренной кости, головке, большом вертеле.
Наиболее типичной формой туберкулезного поражения плечевого сустава является сухая костоеда (caries sicca), которая встречается преимущественно у мужчин и проявляется резким ограничением движений в плече, которое обычно приподнято и прижато к туловищу; имеется выраженная атрофия мышц, но область сустава не припухает, натечников и свищей не образуется. При рентгенографии определяются типичные изменения: уже на ранних стадиях заболевания на латеральной поверхности головки плечевой кости имеются большие округлые и резко очерченные дефекты без секвестров, суставной хрящ разрушен; на поздних стадиях головка плеча может быть полностью или на большом протяжении разрушенной
Туберкулезный полиартрит развивается у больных висцеральным туберкулезом как реактивный процесс, известный под названием «ревматизма Понсе». При этом отмечается преимущественное поражение мелких суставов кистей. Имеются боли и небольшая припухлость суставов; никогда не бывает творожистого распада, свищей. Отмечается параллелизм между суставными проявлениями и активностью других туберкулезных очагов (в легких, урогенитальной сфере и др.). При рентгенологическом исследовании пораженных суставов каких-либо характерных патологических изменений не выявляется. После стихания туберкулезного процесса во внутренних органах наступает полное обратное развитие суставных изменений.
Диагноз. Диагноз туберкулеза суставов обосновывается моноартикулярным типом поражения, анамнестическими указаниями на контакт с туберкулезными больными, обнаружением туберкулеза внутренних органов или лимфоузлов, наличием типичных рентгенологических изменений. Реакция Манту оказывается положительной в большинстве случаев, хотя сама по себе не является строго специфичной. В то же время, если реакция выпадает отрицательной, то диагноз туберкулеза становится весьма сомнительным. Следует помнить, что у стариков и ослабленных больных отрицательная реакция может объясняться резким снижением клеточного иммунитета.
Важное значение для диагностики имеет биопсия синовиальной оболочки, при гистологическом изучении которой обнаруживаются характерные туберкулезные бугорки, а также выделение микобактерий из полости сустава путем посева синовиальной жидкости на питательные среды или заражения лабораторных животных.
Дифференциальный диагноз. Дифференциальная диагностика суставного туберкулеза от других инфекционных артритов базируется на установлении связи со специфической инфекцией, обусловившей поражение суставов, особенностях клиники рентгенологических проявлений и специальных лабораторных исследованиях (посевы крови, синовиальной жидкости, серореакции).
При дифференциальном диагнозе с ревматоидным моноартритом имеет значение последовательное вовлечение в процесс новых суставов, что характерно для ревматоидного поражения, обнаружение РФ. С РА, возникновение которого у больных туберкулезом отнюдь не исключается, приходится иногда дифференцировать ревматизм Понсе. В пользу РА будут свидетельствовать отсутствие четкой связи между активностью суставного процесса и туберкулезными очагами, эффективность противоревматической терапии.
Туберкулез позвоночника (туберкулезный спондилит, болезнь Потта) чаще встречается у детей и людей молодого (20-30 лет) возраста. Костные изменения обычно располагаются по краям тел двух смежных позвонков, при этом быстро вовлекается в процесс и межпозвоночный диск. Реже можно наблюдать центральный тип поражения, когда костный очаг локализуется в центральном участке тела одного какого-либо позвонка, слабо поражая межпозвоночный хрящ. Туберкулезный спондилит обычно имеет характер казеозного остита, быстро подвергается распаду с секвестрацией и образованием перифокального абсцесса. Тело пораженного позвонка сплющивается главным образом в передней части, принимая клиновидную форму.
Клиника. Больной очень рано начинает испытывать боли в спине и ограничение движений. При осмотре обнаруживается мышечный спазм в паравертебральных областях, четко ограниченная одним - двумя позвонками болезненность, определяемая пальпаторно, иногда на глаз заметен выступающий остистый отросток пораженного позвонка. На поздних этапах усиливается грудной кифоз или образуется горб. Могут возникать иррадиирующие боли из-за сдавления нервных корешков. Поясничный отдел поражается реже, чем грудной. У 7 % больных могут быть обнаружены изменения илеосакральных сочленений: чаще всего имеет место односторонний деструктивный сакроилеит, но иногда выявляется и двустороннее поражение.
От анкилозирующего спондилоартрита процесс отличают ред кость поражения илеосакральных сочленений, преимущественная локализация в грудном отделе с резко ограниченной одним - двумя позвонками болезненностью, отсутствие во многих случаях лабораторных признаков воспаления, характерная клиновидная деформация пораженных позвонков, быстрое разрушение межпозвонковых дисков, формирование паравертебральных натечников. При дифференциальном диагнозе следует также иметь в виду вульгарный гнойный спондилит, врожденные клиновидные позвонки, компрессионный перелом, травматический спондилит (болезнь Кюммеля), остеохондропатию позвонка (болезнь Кальве).
Лечение. Лечение больных костно-суставным туберкулезом проводится длительно (не менее двух лет) во фтизиоортопедических лечебницах. Оно преследует цели повысить общую резистентность организма (полноценное питание, длительное пребывание больного на свежем воздухе и др.), ликвидировать общую туберкулезную инфекцию (антитуберкулезные препараты), местный суставной процесс (иммобилизация, хирургическое вмешательство) и в последующем - восстановить функцию сустава и позвоночника (массаж, лечебная гимнастика, физиотерапия).
Сифилитический артрит. Для инфекции, обусловленной бледной спирохетой, наиболее характерным является поражение костей, а не суставов. Артриты обнаруживаются как при приобретенном, так и врожденном сифилисе, особенно в позднем (гуммозном) периоде его. Наибольший контингент больных, страдающих сифилисом суставов, относится к возрасту 20- 30 лет.
Клиника. Различают первично-костную, первично-синовиальную формы артрита, связанные с непосредственным проникновением инфекции в сустав, а также инфекционноаллергический сифилитический артрит.
При раннем врожденном сифилисе (возраст ребенка до 6 лет) обычно обнаруживаются сифилитические остеохондриты, локализующиеся на эпифизарных концах длинных трубчатых костей и сопровождающиеся выраженной периартикулярной припухлостью. Диафизы костей также деформируются в связи с развитием сифилитического периостита и реже специфического остеомиелита. Рентгенологически сифилитический остеохондрит у детей первых месяцев жизни проявляется резким нарушением энхондрального окостенения, развитием внутриметафизарных патологических переломов, которые клинически могут давать картину псевдопаралича Парро. Диафизарный периостит представляет собой характерную рентгенологическую симптоматику муфты или цилиндрического футляра с гладкими контурами, охватывающего весь диафиз кости. Остеомиелитический процесс проявляется некрозом значительных участков кости, однако без секвестрации и свищеобразования.
Одной из характерных форм врожденного сифилиса, которая наблюдается в возрасте 2-6 лет, является сифилитический фалангит (дактилит), приводящий к веретенообразной дефигурации, укорочению, смещению пальцев и иногда ошибочно принимаемый за ревматоидный артрит.
При позднем врожденном сифилисе (возраст 6-16 лет) может наблюдаться клиника хронического доброкачественного гидрартроза, известного под названием «суставы Клаттона». Чаще при этом развивается артрит обоих коленных суставов, хотя и другие суставы могут быть вовлечены. Синовит характеризуется рецидивирующим или вялым течением. Костных изменений в таких случаях не обнаруживается. Цитоз синовиальной жидкости достигает достаточно высоких цифр (50·109 /л), в ней преобладают лимфоциты. У ряда больных поздним врожденным сифилисом картина поражения костно-суставного аппарата ничем не отличается от гуммозного (приобретенного) сифилиса.
Диагноз. Диагноз сифилитического артрита у детей может быть поставлен при наличии других проявлений врожденного сифилиса (кератит, нервная глухота, зубы Гетчинсона).
У больных с приобретенным сифилисом, первичным или вторичным, могут наблюдаться ранние сифилитические артриты (или артралгии), напоминающие ревматизм.
Клиника. Характерны быстропроходящие воспалительные изменения в суставах с болями, выраженными главным образом в первую половину ночи. Поражаются обычно крупные и средние суставы конечностей; кисти и стопы остаются интактными. Выявляют шанкр, кожные высыпания (розеолы), облысение, лимфаденопатию, положительные реакции Вассермана и Закса-Витебского.
На более поздних стадиях в синовиальной оболочке, костях и суставном хряще может развиться сифилитическая гранулематозная ткань. Поражается обычно один сустав (моноартрит), чаще всего коленный или локтевой, голеностопный, плечевой и др. Может наблюдать-
ся сифилитический спондилит. Практически важно, что тазобедренные суставы поражаются редко. Патогномоничным для сифилитического артрита является незначительное нарушение функции сустава при выраженной его дефигурации. Последняя обусловлена утолщением синовиальной оболочки и в меньшей степени выпотом в сустав. Характерно также отсутствие самостоятельной или пальпаторной болезненности в суставе. Однако больной может испытывать ночные боли, а иногда и довольно резкую болезненность в местах локализации гумм, особенно на передней поверхности большеберцовой кости вблизи от сустава. Типичной деформацией при сифилисе является «саблевидная голень», связанная с дугообразным выпячиванием вперед и утолщением большеберцовой кости.
Поражение костно-суставного аппарата нередко является единственным проявлением позднего третичного (гуммозного) сифилиса, когда другие симптомы этой инфекции полностью отсутствуют или слабо выражены. В этот период у 25 % больных может быть отрицательной и реакция Вассермана. Общее состояние больных обычно не страдает, температура нормальная. СОЭ может быть увеличенной. Рентгенологические изменения в суставе выражены в большей степени, чем клинические признаки воспаления, что свидетельствует в пользу сифилитической природы артрита. Важным рентгенологическим симптомом является отсутствие остеопороза, несмотря на значительные деструктивные явления в кости.МОГУТ иметь место овальные или округлые подхрящевые или краевые эпифизарные гуммозные дефекты, убедительно свидетельствующие в пользу сифилиса лишь в тех случаях, когда они располагаются на конце одной, а не обеих составляющих сустав костей. При поражении коленного сустава очень большое диагностическое значение придается увеличению размеров (гиперостозу) надколенной чашечки, а также обнаружению, как правило, клинически просмотренных специфических изменений в диафизах относящихся к пораженному суставу костей.
Диагноз. Диагноз ставят на основании данных анамнеза, внесуставных проявлений сифилиса, клинической, рентгенологической картины и серологических тестов. Дифференциальный диагноз проводят с туберкулезным артритом, табетической артропатией, иногда с болезнью Педжета и другими заболеваниями костей и суставов.
Лечение. Лечение проводится специалистом-венерологом. Чаще применяют препараты пенициллина. Для уменьшения суставных проявлений назначают негормональные антивоспалительные средства.
Лаймовская болезнь - сочетание рецидивирующего моноили олигоартрита с мигрирующей эритемой. Название дано в связи с местностью, где были обнаружены первые случаи заболевания . Заболевание описано в 1975 г. A. Steere вначале как артрит, встречающийся в географически четко очерченных областях, у членов одних и тех же семей или общин. В настоящее время лаймовский артрит зарегистрирован и в Европе. Этиологическим фактором является спирохета Вогrelia burgdorferi, вследствие чего лаймовскую болезнь рассматривают как боррелиоз. Переносчиками инфекции являются иксодовые кле-
щи: в США - Ixodes dammini и I. pocificus, а в Европе- I. ricinus. Клещи I. ricinus встреча-
ются в СССР на территории Прибалтийских республик и Сибири.
Лаймовская болезнь - системное заболевание, вероятно, связанное и с иммунными нарушениями, что подтверждается обнаружением криоглобулинов и ИК в крови и синовиальной жидкости. Болеют преимущественно дети и юноши. Пик заболеваемости приходится на летние месяцы.
Клиника. Основной клинический маркер лаймовской болезни - мигрирующая эритема. На месте укуса клеща обычно появляется красная макула или папула, которая в дальнейшем увеличивается до 16 см и более, а центр пятна бледнеет, но иногда в нем видны интенсивная эритема, индурация, пузырьки, некроз. Кожные высыпания бывают в любом месте, чаще на бедрах, в паховой и подмышечной областях. Из общих симптомов наблюдаются озноб, недомогание, лихорадка, головная боль, скованность в шее и спине, миалгия, лимфа-
денопатия, спленомегалия. В течение нескольких недель или месяцев у 15 % больных появляются неврологические расстройства (менингит, нерезкие симптомы энцефалита, неврит черепных нервов, двигательный или сенсорный радикулоневрит, мононеврит или миелит).
В течение нескольких недель от начала болезни у 8 % больных появляются симптомы поражения сердца, атриовентрикулярная блокада, в некоторых случаях миоперикардит, кардиомегалия, панкардит [Стир А., 1987]. В сроки от нескольких месяцев до 2 лет после начала заболевания у 60 % больных развивается артрит. Он обычно начинается внезапно с умеренной болезненности и припухлости коленных и, реже, других крупных суставов, в ряде случаев наблюдается симметричный полиартрит. Суставной синдром длится не более недели, не вызывает стойких дефигураций, но может рецидивировать на протяжении ряда лет. У 10 % больных поражение крупных суставов становится хроническим с признаками деструкции хряща и кости. При биопсии синовиальной оболочки обнаруживаются отложения фибрина, гипертрофия ворсин, пролиферация сосудов и выраженная плазмоцитарная и лимфоцитарная инфильтрация. В некоторых случаях при окраске серебром выявляются спирохеты. Число лейкоцитов в синовиальной жидкости составляет 5·102 -11·104 /мл, наибольшую часть из них составляют сегментоядерные нейтрофилы. Отмечают повышенное содержание белка, нормальный или сниженный уровень глюкозы, тесты на ревматоидный и антинуклеарный факторы обычно отрицательны.
Выделение культуры спирохеты позволяет достоверно установить диагноз, однако это удается редко. Через несколько недель от начала инфекции диагностическим критерием почти всегда может служить обнаружение IgG-антител к спирохете, что позволяет отдифференцировать лаймовский артрит от других воспалительных поражении суставов. Хотя антитела к В. burgdorferi перекрестие реагируют с другими спирохетами, включая и бледную спирохету, реакция Вассермана у больных лаймовским артритом всегда отрицательна.
Лечение. На ранних стадиях препаратом выбора для взрослых является тетрациклин в дозе 250 мг 4 раза в сутки. Вместо него могут быть применены феноксиметилпенициллин в дозе 500 мг 4 раза в сутки или эритромицин в дозе 250 мг 4 раза в сутки. Терапия должна продолжаться 10-20 дней. Салицилаты «обрывают» суставной синдром. При стойком артрите рекомендуются пролонгированные препараты пенициллина по 2 400 000 ЕД в неделю в течение 3 нед или внутривенное введение пенициллина по 20000000 ЕД в сутки дробно в течение 10-20 дней, что эффективно в 50% случаев . При отсутствии эффекта от противомикробной терапии производят синовэктомию.
Болезнь Уипла (интестинальная липодистрофия) - редкое заболевание, проявляющееся мигрирующим артритом и прогрессирующим поражением тонкой кишки (диарея, стеаторея - «жирный стул», в тяжелых случаях синдром нарушенного всасывания). Начало болезни обычно наблюдается в возрасте 30-50 лет, причём мужчины болеют намного чаще женщин (9:1).
Этиология и патогенез. В прошлом болезнь Уипла рассматривали как первичное нарушение жирового обмена. В настоящее время имеются доказательства, что это, повидимому, системная инфекция, которая может поражать любые органы или ткань, хотя преимущественно проявляется патологией суставов и тонкой кишки .
В слизистой оболочке кишки, синовиальной ткани, а также практически в каждом органе можно обнаружить при электронно-микроскопическом исследовании стержневидные включения микроорганизмов, которые исчезают после лечения антибиотиками . Важнейший диагностический признак этого заболевания - наличие многоядерных пенистых клеток в слизистой оболочке и лимфатических узлах пораженной кишки, макрофагов, содержащих ШИК-положительные (гликопротеиновые) гранулы, - объясняют незавершенным фагоцитозом этих бактерий, которые называют бациллами Уипла. Однако получить культуру микроорганизма в лабораторных условиях пока не удалось.
Клиника. Перед появлением классических симптомов кишечного поражения могут пройти годы и даже десятилетия. Продромальные явления могут относиться к изменениям практически любого органа, но наиболее типичны небольшая лихорадка, потеря массы тела, не связанная с диареей, гиперпигментация кожных покровов, лимфаденопатия, гипотония, склонность к развитию полисерозитов и пр. Самый частый продромальный синдром - интермиттирующий, а иногда и длительно текущий неэрозивныи артрит, не отличающийся от артритов при других энтерогенных инфекциях; иногда выявляется сакроилеит;
В крови обнаруживаются анемия и лейкоцитоз с нейтрофилезом. Характерным признаком синовиального выпота считается высокое содержание в нем мононуклеарных клеток. Характерные признаки развернутой стадии болезни: лихорадка, снижение массы тела, понос, ухудшение процессов всасывания в кишечнике.
В прошлые годы до применения антибиотиков заболевание заканчивалось смертью; в настоящее время антибиотикотерапия обрывает течение болезни.
Диагноз. До появления патологических изменений со стороны желудочно-кишечного тракта диагноз поставить трудно. При наличии системных проявлений процесс принимают за ревматоидный артрит, саркоидоз, болезнь Аддисона и др. На стадии кишечного поражения диагностика становится достаточно простой. В ряде случаев приходится использовать рентгенографию тонкой кишки, лапаротомию с биопсией лимфатических узлов или пероральную биопсию слизистой оболочки тонкой кишки для выявления характерных гистологических изменений.
Лечение. Назначают пенициллин (по 1 000 000-2 000 000 ЕД/сут) и стрептомицин (1 г/сут) в теченние 10-14 дней, а затем тетрациклин (0,5-1 г/сут) в течение года, так как прекращение лечения в более ранние сроки может обусловить возобновление процесса.
Негормональные антивоспалительные средства применяются симптоматически; от назначения кортикостероидов в настоящее время воздерживаются.
Вирусные артриты. Эти заболевания суставов возникают обычно в остром периоде какого-либо вирусного заболевания и обусловлены проникновением возбудителя в ткани сустава или индукцией им иммунных реакций, проявляющихся суставным воспалением.
Вирусный гепатит может сопровождаться суставным синдромом различной клинической выраженности. Так, в преджелтушном периоде на фоне HBs-антигенемии могут появляться артралгии или реактивные артриты, которые исчезают в разгар желтухи. Иногда артикулярные проявления задерживаются на несколько месяцев, симулируя картину серонегативного неэрозивного ревматоидного артрита. Однако в дальнейшем наступает полное клиническое излечение суставного процесса [Апросина 3. Г., 1981].
Давно существующий у больного ревматоидный артрит может обостряться или, напротив, принимать более благоприятное течение после перенесенной эпидемической желтухи.
В последние годы описаны единичные, но несомненные случаи развития у больных вирусным гепатитом классического ревматоидного артрита, длящегося в течение многих лет и характеризующегося соответствующими клинико-рентгенологическими и иммунологиче-
скими признаками [Тареев Е. М. и др., 1979; Morris V., Stevens V., 1978].
Это свидетельствует о сложности взаимоотношений между вирусной инфекцией, вызывающей гепатит, и суставными поражениями, в частности с ревматоидным артритом. Несмотря на это, в каждом конкретном случае необходимо стремиться дать нозологическую характеристику суставному процессу: параллелизм между симптомами артрита и течением процесса в печени более свойствен вирусному поражению суставов; появление костных узур, подвывихов, анкилозов, ревматоидного фактора в высоких титрах более типично для ревматоидного артрита.
Краснуха. Вирус краснухи, вероятно, обладает особым тропизмом к суставным тканям. Возможно его роль при таких хронических заболеваниях суставов, как ювенильный ревматоидный артрит и ревматоидный артрит взрослых. Истинный краснушный артрит развивается обычно у молодых женщин после вакцинации или перенесших краснуху, во время или вскоре после исчезновения типичной для этого заболевания сыпи. Чаще всего воспалительные изменения возникают в мелких суставах кистей, включая запястья, что иногда обусловливает появление синдрома запястного канала. Реже поражаются коленные, голеностопные и другие суставы. Процессу сопутствует лимфаденопатия. СОЭ обычно не увеличена. Ревматоидный фактор в крови может обнаруживаться лишь при затяжном артрите, исчезая по мере выздоровления . Процесс продолжается в среднем в течение 1 мес.
Эпидемический паротит иногда приводит к развитию моно-или олигоартрита, чаще процесс наблюдается у мужчин в возрасте 20-50 лет. Поражаются крупные суставы конечностей обычно к концу 2-й недели вирусного заболевания. Артрит возникает остро, характеризуясь сильными болями, значительной припухлостью пораженного сустава, повышением кожной температуры и нарушением его функции. СОЭ умеренно увеличена, имеется нейтрофильный лейкоцитоз. Артрит длится 2 нед-2 мес и завершается полным выздоровлением.
Карельская лихорадка - выявленная в средней Карелии арбовирусная инфекция взрослых, передающаяся, вероятно, лесными кровососущими насекомыми. Пик заболеваемости приходится на август - сентябрь. Болезнь начинается остро с лихорадки, появляются розеолезная и папулезная сыпь, артралгии, а также артриты, которые могут принимать затяжное и хроническое течение по типу ревматоидного артрита [Львов Д. К. и др., 1983].
Лечение вирусных поражений костно-суставной системы проводится с использованием антивоспалительных средств, местно физиотерапии, а при необходимости (в случае вторичного гнойного воспаления) и оперативных вмешательств.
Цинга - профессиональный инфекционный моноартрит пальцев рук, возникающий у северных поморов - зверобоев, добывающих ластоногих. Заболевание впервые описано в 1937 г. Н. А. Верховским, а затем норвежскими исследователями, назвавшими болезнь «сальным пальцем» (speck finger, bluster finger). Возбудитель не установлен. Заражение происходит через кожные трещины, царапины во время разделывания туш тюленей. Инкубационный период длится 2-20 дней, а затем в одном из межфаланговых или пястнофаланговых суставов, чаще на левой руке, возникают резчайшие, мучительные боли, приводящие больного к полной потере трудоспособности и лишающие сна. Одновременно появляются сильная припухлость, тугоподвижность в суставах, а затем хруст и смещение суставных концов костей. Температура тела остается нормальной, показатели крови не изменяются, регионарные лимфатические узлы не увеличиваются.
Ренггенологически выявляются деструктивные процессы в эпифизах, сужение суставных щелей, патологические подвывихи, на поздних стадиях-анкилозы [Гаврилова К. М., 1958].
Болезнь в суставах нарастает в течение 2-4 нед, а затем постепенно уменьшается. Весь процесс длится до 6 мес, оставляя после себя контрактуру, полную неподвижность или разболтанность сустава.
Грибковые артриты. Имеется множество грибковых заболеваний, часть из которых распространена повсеместно (актиномикоз, кандидамикоз, споротрихоз и др.), другие ветре-. чаются лишь в строго определенных районах мира (например, бластомикоз, кокцидиоидоз и др.) Каждое грибковое заболевание имеет свою характерную клиническую картину, обу-
словленную поражением различных органов и систем. Костно-суставной аппарат при этом поражается редко и, как правило, в период генерализации заболевания. Первичные очаги возникают в костях (череп, нижняя челюсть, позвонки, эпифизы и диафизы трубчатых костей), в которых могут развиться, как при остеомиелите, деструктивные и периостальные процессы с образованием гнойников и свищей в окружающих тканях. Суставы поражаются чаще всего вторично, вследствие распространения процесса из близлежащего костного очага. Обычно встречается моноили олигоартрит, дифференциальный диагноз которого от других артритов (туберкулезного, септического и др.) может быть затруднительным.
Диагностике помогают эпидемиологический анамнез, наличие внесуставных признаков грибковой инфекции, положительные кожные тесты с грибковыми антигенами или специфические серореакции, обнаружение мицелия грибка в отделяемом из свища или в гнойном содержимом суставной полости.
Лечение. Антибиотики, анальгетики, хирургический дренаж суставов и вскрытие гнойников в мягких тканях.
А р т р и т ы п р и п а р а з и т а р н о й и н в а з и и. Глистная инвазия (в част-
Дизентерийный артрит - чрезвычайно редкое осложнение острой или хронической дизентерии, вызванной чаще всего шигеллами Флекснера. В разгаре дизентерии наблюдаются артралгии, преходящие артриты многих суставов, особенно коленных и голеностопных, в более позднем периоде наблюдается клиника болезни Рейтера или подострого и даже хронического полиартрита, напоминающего ревматоидный, изредка возможно и развитие инфекционного артрита . Относительно часты субклинически протекающие сакроилеиты, устанавливаемые при рентгенографическом исследовании.
Д и з е н т е р и й н ы й а р т р и т даже при хроническом течении (1- 2 года) заканчивается полным выздоровлением.
Диагноз. Диагноз основывается на хронологической связи суставных проявлений с инфекцией шигеллами, подтвержденной при бактериологическом и серологическом исследовании.
Лечение. Возможно раннее применение антимикробной терапии с целью устранения основного заболевания и назначение негормональных антивоспалительных средств для снятия боли и воспалительных явлений в суставах.
И е р с и н и о з н ы й а р т р и т. Yersinia enterocolitica - микроорганизм, кото-
рый привлек к себе внимание ревматологов сравнительно недавно . Он входит в один ряд "с возбудителями чумы и псевдотуберкулеза, но заболевания, вызываемые им, не относятся к числу особо опасных инфекций,
Инфекция, обусловленная иерсиниями, встречается у животных и людей, причем из 30 известных серотипов микроба для человека являются патогенными лишь немногие.
В большинстве случаев иерсиниозный артрит рассматривается как «реактивный», но известно и о септических вариантах воспаления суставов.
Клиника. У человека основные симптомы иерсиниоза связаны с поражением кишечника, которое проявляется обычно острым энтероколитом. Может иметь место диарея, иногда с примесью крови и слизи. В таких случаях обычно подозревают дизентерию, которая не находит, однако, бактериологического подтверждения. Иногда может иметь место неопределенный болевой абдоминальный синдром или клиника аппендицита, вернее, псевдоаппендикулярного синдрома, обусловленного терминальным илеитом, воспалением брыжеечных лимфатических узлов (мезаденит) или комбинацией этих процессов. Желудочно-кишечные проявления могут быть легкими, стертыми, кратковременными, но иногда крайне выраженными, сопровождаясь септицемией, обезвоживанием организма и приводя больных к гибели.
Артрит обычно возникает через 1-3 нед после энтероколита или абдоминального синдрома, иногда развивается одновременно с энтероколитом или даже ^а 1-2 дни предшествует ему. Поражаются крупные и средние суставы нижних конечностей, изредка суставы рук. Обычно имеется лихорадка (38-39 °С), лейкоцитоз (1210 /л и более), увеличена СОЭ. Артрит в большинстве случаев похож на ревматический, но при нем не обнаруживается стерептококковых антител, а выявляются антитела к иерсиниям в высоком титре. Синовиальная жидкость воспалительная, не содержит микробов, но в ней могут быть обнаружены специфические антитела.
Артрит длится 1-5 мес и заканчивается полным выздоровлением, но может рецидивировать или даже приобретать хроническое течение. При иерсиниозном артрите описано развитие триады Рейтера: конъюнктивит, уретрит, артрит.
При иерсиниозной инфекции нередко развивается инфекционно-аллергический миокардит, что наблюдается примерно у 1/3 больных. Поражения эндокарда и клапанов сердца обычно не наступает . У 18- 20 % больных констатируют узловатую эритему, характеризующуюся доброкачественным течением с полным обратным развитием на протяжении 2-3 нед. Относительно часты поражения глаз (эписклерит, конъюнктивит, увеит и др.).
Диагноз иерсиниозного артрита основывается на анамнестических данных, бактериологическом исследовании кала, обнаружении антител к иерсиниям в сыворотке крови (в диагностическом титре 1:200 и более) или синовиальной жидкости.
Лечение. Иерсинии чувствительны к тетрациклину. Этот антибиотик рекомендуется назначать в остром периоде процесса (1-2 г/сут), добавляя и негормональные антивоспалительные препараты. К кортикостероидным препаратам следует прибегать лишь при крайней выраженности воспалительной активности суставного процесса, значительном поражении глаз или при прогрессировании инфекционно-аллергического миокардита.
В данном разделе перечислены далеко не все артриты, которые могут сочетаться
с разнообразными инфекциями, но уже. изложенное свидетельствует о широком спектре подобных заболеваний суставов. Некоторые из этих артритов встречаются достаточно часто (например, иерсиниозный, бруцеллезный, гонококковый, острый инфекционный, туберкулезный), другие являются редкостью (лаймовская болезнь, Уиппла болезнь). Выделение группы артритов, связанных с инфекцией, диктует необходимость поиска конкретных этиологических факторов заболеваний суставов и дальнейшего уточнения механизмов их патогенеза.
Воспалительный процесс в суставах может развиваться при заболеваниях кишечника — неспецифическом язвенном колите (НЯК) и болезни Крона.
Неспецифический язвенный колит — хроническое воспалительное заболевание толстой кишки невыясненной этиологии, характеризующееся воспалением с развитием местных и системных осложнений.
Болезнь Крона (регионарный энтерит, терминальный илеит) — хроническое неспецифическое трансмуральное гранулематозное воспаление чаще терминального отдела тонкой кишки, распространяющееся на брыжейку и регионарные лимфатические узлы.
Основное значение в патогенезе придается нарушениям как регионарной иммунной системы кишечника, так и иммунореактивности организма в целом. Отмечается циркуляция аутоантител и ЦИК в кровяном русле и дисбаланс между Т-хелперами и Т-супрессорами в кишечной стенке.
Отмечено преобладание активности Т-хелперов, угнетение Т-супрессоров, снижение выработки ИЛ-2. В органах и тканях накапливаются Т-клеточные клоны, несущие маркеры CD4 клеток. Такие клоны со свойствами хелперов 1-го типа способны длительно поддерживать активированное состояние окружающих их макрофагальных и эпителиоидных клеток, формируя длительно существующий очаг аутоиммунного воспаления в виде гранулемы (при болезни Крона), или проявлять цитотоксические свойства и вызывать повреждение сосудистых и тканевых структур кишечника (при НЯК). Воспалительный процесс в кишечнике вызывает повышение кишечной проницаемости и способствует проникновению аутоантител и ЦИК из просвета кишечника в кровяное русло, вызывая системный иммуновоспалительный процесс с поражением сосудов, синовиальной оболочки суставов и связочного аппарата позвоночника.
Гистоморфологически при НЯК определяется отек слизистой оболочки кишечника, выраженная контактная кровоточивость, множественные эрозии. Поверхность слизистой оболочки покрыта фибринозным налетом.
При болезни Крона воспалительный процесс начинается в подслизистой оболочке кишки и распространяется на всю стенку кишечника. На фоне лимфо- и плазмоцитарной инфильтрации отмечаются гиперплазия лимфоидных фолликулов и пейеровских бляшек, гранулематозная реакция, распространяющаяся на мышечную оболочку и подсерозную основу. Лимфоидные фолликулы изъязвляются, глубоко проникают в мышечный слой, образуя свищи, абсцессы, стриктуры (Крикунов В. П., Головизнин М. В., 1997).
Артрит периферических суставов у пациентов с неспецифическим язвенным колитом и болезнью Крона развивается чаще при распространенном поражении толстого кишечника. Преимущественно артрит отмечается в первые годы после начала заболевания кишечника. В 60—70% случаев артрит возникает при обострениях кишечной патологии, но иногда он предшествует симптомам основного заболевания, особенно у детей с болезнью Крона.
Артрит периферических суставов отмечается при НЯК в 15%, а при болезни Крона в 20% случаев. Наиболее характерно поражение суставов нижних конечностей. В дебюте характерно острое начало суставного синдрома в варианте моноартрита с поражением коленного или голеностопного сустава с одной стороны. Затем в течение последующих дней в процесс вовлекаются симметрично коленные, голеностопные, плечевые, локтевые суставы. Поражение мелких суставов менее характерно. Иногда при болезни Крона суставной синдром может характеризоваться мигрирующими артралгиями, а также эрозивным артритом и деформацией суставов.
Сакроилеит выявляется у 25% больных с НЯК и у 15% с болезнью Крона. Характерен симметричный сакроилеит. Частота встречаемости HLA-B27 при сакроилеите у больных с болезнью Крона составляет 55%, у больных с НЯК - 70%.
Клинические особенности поражения позвоночника напоминают таковые при анкилозирующем спондилоартрите. Поражение позвоночника чаще встречается у мужчин, чем у женщин (3:1). Характерны жалобы на боль в спине и длительную скованность, особенно по ночам и после пробуждения. Скованность уменьшается при движении и выполнении упражнений. При объективном обследовании выявляется болезненность крестцово-подвздошных сочленений, выраженное нарушение подвижности позвоночника и иногда — уменьшение дыхательных экскурсий грудной клетки. Начало сакроилеита и спондилита может предшествовать, совпадать или отставать от начала болезни Крона или НЯК, а активность спондилоартрита совершенно не зависит от активности воспалительного процесса в кишечнике.
Типичные рентгенологические признаки сакроилеита и спондилита у больных с воспалительными заболеваниями кишечника аналогичны таковым при анкилозирующем спондилите.
Нередко при болезни Крона выявляется тендинит ахиллова сухожилия (подошвенный фасциит), изменения фаланг в виде «барабанных палочек», гипертрофическая остеоартропатия, абсцесс в области поясничной мышцы и инфекционный артрит тазобедренного сустава в результате образования фистулы.
Поражение глаз в виде иридоциклита характерно для больных с НЯК и сочетается со спондилитом. У больных с болезнью Крона при наличии полиартрита в 50% случаев выявляется конъюнктивит и эписклерит. Появление глазных симптомов связано с обострением течения основного заболевания.
Кожные симптомы характеризуются гангренозной пиодермией у 12% больных с НЯК и узловатой эритемой у 9% больных с НЯК и 15% больных с болезнью Крона.
Сравнительно редким осложнением болезни Крона является диффузный некротизирующий гломерулонефрит, проявляющийся протеинурией, гематурией, нефротическим синдромом.
Описываются сочетания НЯК с саркоидозом и болезнью Такаясу и болезни Крона с синдромом Бехчета (Крикунов В. П., Головизнин М. В., 1997).
Лечение артрита периферических суставов и суставов позвоночника, связанного с воспалительными заболеваниями кишечника, осуществляется на принципах, единых для ССА. При этом следует помнить, что НПВП могут вызвать обострение воспалительного процесса в кишечнике. С целью уменьшения болевого синдрома при артритах, тендинитах и сакроилеите применяются локальные инъекции ГКС. Из базисных препаратов наиболее эффективен сульфасалазин в дозе 2—3 г/сут; при преобладании артрита периферических суставов возможно применение метотрексата в дозе 7,5-15 мг/сут. При сочетании с системными васкулитами показано назначение ударных доз ГКС и цитостатиков (циклофосфан, циклоспорин А).
Реактивный артрит – наиболее часто встречающееся поражение суставов, которое развивается при наличии в организме бактериальных либо вирусных инфекционных агентов. Характеризуется поражением комплекса тканей сустава (главным образом гиалинового хряща и сухожилий). Кроме того, патологические процессы возможны в целом ряде других органов – в роговице глаза, коже и слизистых оболочках, сердце.
Некоторые разновидности этого патологического состояния имеют свои собственные названия – например, артрит, сочетающийся с поражением слизистых оболочек мочеполового тракта и роговицы глаза, часто называют «синдром Рейтера». Для реактивного артрита также типично большое разнообразие проявлений и выраженности симптомов, что затрудняет диагностику и последующее лечение. Считается, что оно с одинаковой частотой возникает как у мужчин, так и у женщин. Но если пуск патологического процесса был обусловлен урогенитальной или венерической инфекцией, то такой вариант развития событий встречается чаще в несколько раз у мужчин.
Главным отличием этого состояния от других форм поражения суставов является относительная легкость симптомов, отсутствие тяжелых поражений внутренних органов, другие показатели лабораторных анализов – в частности, низкий показатель уровня ревматического фактора. Все это позволило выделить реактивный артрит в отдельное заболевание с большим диапазоном причин и проявлений. Пик его распространенности приходится на возраст 20-30 лет, однако возможно появление патологии в любом возрасте, включая детский. Реактивный артрит у детей имеет ряд особенностей, особенно в плане лечения.
Причины заболевания
Реактивный артрит относится к группе аутоиммунных поражений суставов, то есть близок по своему происхождению к ревматоидному артриту и другим заболеваниям иммунной системы, протекающим с различными повреждениями тканей суставов. Суть этих патологий сводится к тому, что после проникновения бактериального инфекционного агента в организм иммунитет «сходит с ума» и начинает атаковать свои собственные ткани. Предрасполагающими к этому факторами являются некоторые генетические особенности. Например, при наличии определенной разновидности гена гистосовместимости вероятность заболеть реактивным артритом повышается у человека в десять-двадцать раз. Этот ген отвечает за формирование особых «визитных карточек» всех клеток нашего организма, за счет которых иммунная система не атакует свои собственные ткани. Нарушение такой идентификации и является главной причиной подобных заболеваний.
Другим фактором, способствующим развитию реактивного артрита, является схожесть компонентов бактериальной стенки болезнетворных микробов с элементами клеточной мембраны человека. В результате этого иммунитет начинает рассматривать наличие таких белков как угрозу и атакует любые структуры, где они расположены. Далеко не каждая бактерия имеет схожие с человеческими антигены, этим объясняется развитие реактивного артрита только после определенных инфекций. В целом, можно выделить несколько основных групп причинных факторов в развитии этого состояния:
- Венерические и урогенитальные инфекции – наиболее часто артрит возникает в результате заражения хламидиями. Замечено, что после хламидийной инвазии реактивный артрит намного чаще развивается у мужчин, чем у женщин. Ряд специалистов связывает это с особенностями мужской половой системы и уровнем иммунитета в этой области.
- Кишечные инфекции – также являются нередкой причиной развития поражения суставов. Такое осложнение особенно характерно для дизентерии и подобных ей заболеваний. За счет типичной симптоматики кишечной инфекции постановка диагноза «постдизентерийная артропатология» не представляет большой сложности.
- Инфекции дыхательных путей – возбудители ларингитов, трахеитов, бронхита могут способствовать развитию поражения суставов и других тканей.
- Иммунизация организма – редкой причиной реактивного артрита может быть неудачно произведенная вакцинация или лечение иммунологическими сыворотками. Как правило, в таком случае имеет место неправильное введение (прививка на фоне ослабленного или больного организма, нарушения дозировки) либо же генетические особенности организма.
- Неуточненная артропатия – такой диагноз ставится в том случае, когда нет четкой корреляции между поражением суставов и предшествовавшей инфекцией или иммунизацией. Большинство специалистов полагает, что такой тип поражения возникает при отсутствии информации о предыдущем заболевании (о наличии которого человек мог просо забыть), а некоторые варианты неуточненной артропатии являются легкими формами ревматоидного артрита.
Симптомы заболевания
Так как реактивный артрит является аутоиммунным заболеванием, поражение непосредственно суставов является лишь «вершиной айсберга». За счет этого все симптомы и проявления патологии можно разделить на две большие группы:
- Суставные проявления – поражение суставов и окружающих их тканей.
- Внесуставные симптомы – нарушения в работе других органов и систем.
Суставные симптомы
Ведущим проявлением поражения суставов при этом заболевании является их воспаление с его характерными признаками – болью, отеком, покраснением, локальным повышением температуры. Первые признаки нарушений в работе суставов появляются в среднем через три-четыре недели после начала инфекционного процесса, который запускает всю цепь патологических процессов. Это может быть начало хламидиоза, диарея вследствие кишечной инфекции, кашель и першение в горле. В первую очередь наиболее часто поражаются крупные суставы нижних конечностей – коленный, голеностопный, тазобедренный. Кроме того, типичным для реактивного артрита является сакроилеит (воспаление сочленений крестца с тазовыми костями) – он возникает в 95% случаев заболевания.
- В начальный период возникает боль, нарушение подвижности в сочленении, которое сопровождается общим недомоганием и повышением температуры. Локализация боли зависит от пораженного сустава – типичной клинической картиной считаются боли в пальцах ног, стопе, коленях, ягодицах и пояснице;
- При нарастании проявлений реактивного артрита возникает отек и покраснение области пораженного сустава, что еще больше сковывает движения в нем. Локализация боли становится смазанной – патологический процесс начинает переходить на окружающие сочленение сухожилия и мышцы;
- В отсутствии лечения воспаление охватывает еще больший комплекс тканей, что проявляется усилением отека и боли. В пальцах ног при этом может развиваться дактилит – воспаление мягких тканей, который является серьезным осложнением.
Внесуставные симптомы
Поражение других органов и тканей при реактивном артрите может иметь различную степень проявлений – это зависит от большого количества факторов. Бывает, что данные проявления превалируют над поражением суставов, и являются причиной тяжелых и даже угрожающих жизни осложнений. С другой стороны, некоторые формы заболевания проявляются практически исключительно артропатией. Внесуставные проявления патологии можно разделить на несколько групп:
- Общие симптомы – являются самым первым признаком заболевания, опережая даже боли в суставах и возникают примерно через две-три недели после инфекционного поражения. Суть их заключается в повышении температуры до средних цифр (37,4-37,8), недомогании, незначительной потере веса. Помимо всего прочего возможны признаки нарушения иммунной системы – могут увеличиваться отдельные группы лимфатических узлов (паховые, подмышечные).
- Поражение органов зрения – проявляется в виде воспалений различных тканей глаза и наиболее часто встречается при реактивном артрите. Это может быть конъюктивит (покраснение и зуд глаз, ощущение «песка», слезотечение), увеит и иридоциклит. Последний является одним из опасных проявлений этого заболевания, так как без должного лечения может приводить к полной слепоте.
- Кожные проявления и поражение слизистых оболочек – также нередко сопровождает болезнь суставов. Так как поражается соединительнотканная основа кожи, это служит причиной снижения ее эластичности, появление участков гиперкератоза, возможны проблемы с производными кожи – волосы могут выпадать, ногти становятся желтыми и ломкими. На слизистых оболочках полости рта и половых органов возникает большое количество язвочек. Сами по себе они неопасны и при лечении полностью исчезают, однако они могут служить «входными воротами» для вторичной инфекции.
- Поражение органов сердечно-сосудистой системы – является более редким, но самым грозным проявлением реактивного артрита. Суть подобных проявлений заключается в воспалении некоторых слоев сердца и аорты – миокардита, эндокардита с поражением клапанов, мезоаортита. Практически все эти синдромы характеризуются появлением тупых ноющих болей в области сердца, нарушением сердечного ритма. Эти проявления опасны своими последствиями – от возникновения стойких аритмий до развития приобретенного порока сердца и сердечной недостаточности. Реактивный артрит у детей наиболее часто дает осложнения на сердце, поэтому необходимо уделять большое внимание лечению этой болезни у маленьких пациентов.
Диагностика заболевания
Ключевыми исследованиями в плане диагностики реактивного артрита являются следующие анализы и методы:
- Рентгенография суставов – могут быть заметны изменение толщины и структуры гиалинового хряща;
- Биохимический анализ крови – особенно важно наличие или отсутствие ревматоидного фактора. Нередко лишь это исследование позволяет различить ревматизм и ревматоидный артрит от реактивного поражения суставов;
- Анализ суставной жидкости – позволяет отличить реактивный артрит от инфекционного поражения сустава.
Важнейшую роль в диагностике этого состояния, помимо клинических исследований, играет правильный сбор анамнеза и истории жизни человека. Если за несколько недель до начала заболевания у него наблюдался хламидиоз, диарея, простудное заболевание – можно с высокой степенью вероятности ставить диагноз.
Кроме того, заподозрить наличие этой болезни позволяет характерная клиническая картина симптомов:
- Поражение одновременно нескольких суставов (до пяти);
- Главным образом страдают крупные сочленения нижней половины тела – таза, позвоночника и ног;
- Заболевание затрагивает, как правило, нессиметричные суставы.
Как дополнение к основным методам диагностики можно использовать генетический анализ на наличие варианта гена гистосовместимости HLA-B27 – он встречается более чем в 90% случаев заболевания.
Лечение патологии
Лечение этого заболевания можно разделить на три основных направления:
- Терапия основного инфекционного заболевания, которое стало причиной развития реактивной артропатии;
- Уменьшение проявлений воспаления в суставах и других органах для облегчения течения болезни и снижения вероятности развития осложнений;
- Уменьшение активности иммунной системы, которая атакует собственные ткани.
Терапия основного заболевания
В плане первого пункта подразумевается использование противомикробных лекарственных средств – антибиотиков и сульфаниламидов. Важно правильно подобрать наиболее эффективный в каждом конкретном случае препарат. Для этого следует подтвердить диагноз хламидиоза (при урогенитальной инфекции), сделать бактериологическое исследование кала (при кишечном заболевании) или мокроты (при поражении дыхательных путей). После определения типа возбудителя подбирается наиболее эффективный противомикробный препарат. Если подобные исследования затруднены или занимают много времени, возможно назначение лекарственных средств с широкого спектра действия – Доксициклин, Спирамицин. При реактивном артрите у детей применяют эффективный и безопасный антибиотик Азитромицин (Сумамед).
Снижение воспалительных процессов
Воспаление в суставах является главной причиной болей и отека. Кроме того, при этом выделяется большое количество биологически активных веществ, которые приводят к еще большему разрушению тканей (вторичная альтерация). Поэтому уменьшение воспаления играет большую роль в терапии реактивного артрита. Наиболее часто для этого применяют различные НПВС – Диклофенак натрия, Индометацин, Ибупрофен. Они эффективно обезболивают и снижают активность воспалительных процессов. В тяжелых случаях уменьшить воспаление возможно применением гормональных средств – глюкокортикоидов (Преднизолон). Их вводят непосредственно в полость пораженного сустава – однако делать это следует только после анализа суставной жидкости, который должен подтвердить отсутствие патогенных микроорганизмов.
Уменьшение активности иммунитета
Так как реактивный артрит вызван повышенной активностью иммунной системы к собственным тканям, можно уменьшить проявление болезни путем приема иммуносупрессоров – Метотрексата, Азатиоприна. Лечение ими должно проходить только по назначению и под полным контролем врача, так как возможно развитие иммунодефицита. Детям эти препараты назначают только в самом крайнем случае и только в условиях стационара.
Помимо основного лечения применяют симптоматическую терапию – гидрокортизоновую мазь при гиперкератозе кожи, глазные капли глюкортикоидов при иридоциклите.
Какой-либо специфической профилактики при этом состоянии нет. Из общих принципов можно выделить избегание инфекционных заболеваний и их своевременное лечение в полном объеме. Особенно важно этих правил придерживаться лицам с геном HLA-B27 – будущим родителям при подготовке к зачатию ребенка также следует пройти генетическое консультирование по этому вопросу. Если появились симптомы болезни, особенно после недавнего пищевого отравления или простуды – нельзя затягивать с посещением врача, ранняя диагностика позволит избежать тяжелых осложнений.








