Который образуется в особых клетках юкстагломерулярного аппарата почки (ЮГА). Секрецию ренина стимулируют уменьшение объёма циркулирующей крови, снижение кровяного давления, b 2 -агонисты, простагландины Е 2 , I 2 , ионы калия. Повышение активности ренина в крови вызывает образование ангиотензина I - это пептид из 10 аминокислот, который отщепляется от ангиотензиногена. Ангиотензин I при действии ангиотензинпревращающего фермента (АПФ) в легких и в плазме крови переходит в ангиотензи II.
Он вызывает синтез в клубочковой зоне коры надпочечников гормона альдостерона. Альдостерон поступает в кровь, переносится к почке и действует через свои рецепторы на дистальные канальцы мозгового вещества почки. Суммарный биологический эффект альдостерона - задержка NaCl, воды. В результате восстанавливается объём жидкости, циркулирующей в кровеносной системе, в том числе увеличивается почечный кровоток. Это замыкает отрицательную обратную связь и синтез ренина прекращается. Помимо этого, альдостерон вызывает потерю с мочой Mg 2+ , K + , H + .В норме эта система поддерживает артериальное давление (рис.25).
Рис. 25. Ренин-ангиотензин-альдостеровая система
Избыток альдостерона - альдостеронизм , бывает первичным и вторичным. Первичный альдостеронизм может быть вызван гипертрофией клубочковой зоны надпочечников, эндокринной эпатологией, опухолью (альдостеронома). Вторичный альдостеронизм наблюдается при заболеваниях печени, (альдостерон не обезвреживается и не выводится), или при заболеваниях сердечно-сосудистой системы, в результате которых ухудшается кровоснабжение почки.
Результат одинаковый - гипертензия, а при хроническом процессе альдостерон вызывает пролиферацию, гипертрофию и фиброз сосудов и миокарда (ремоделирование), что ведет к хронической сердечной недостаточности. Если она связана с избытком альдостерона, назначают блокаторы рецепторов альдостерона. Например, спиронолактон, эплеренон это калийсберегающие диуретики, они способствуют выведению натрия и воды.
Гипоальдостеронизм - недостаток альдостерона, возникает при некоторых заболеваниях. Причинами первичного гипоальдостеронизма могут быть туберкулез , аутоиммунное воспаление надпочечников, метастазы опухолей, резкая отмена стероидов. Как правило, это недостаточность всей коры надпочечников. Острая недостаточность может быть вызвана некрозом клубочковой зоны, кровоизлиянием или острой инфекцией. У детей может наблюдаться молниеносная форма при многих инфекционных заболеваниях (грипп, менингит), когда ребёнок может умереть за одни сутки.
При недостаточности клубочковой зоны снижается реабсорбция натрия, воды, падает объём циркулирующей плазмы; увеличивается реабсорбция К + , Н + . В результате резко снижается АД, нарушается электролитный баланс и кислотно-щелочное равновесие, состояние опасно для жизни. Лечение: внутривенное введение солевых растворов и агонисты альдостерона (флудрокортизон).
Ключевое звено в РААС - это ангиотензин II, который:
Действует на клубочковую зону и увеличивает секрецию альдостерона;
Действует на почку и вызывает задержку Na + , Cl - и воды;
Действует на симпатические нейроны и вызывает освобождение норадреналина, мощного вазоконстриктора;
Вызывает вазоконстрикцию - суживает сосуды (в десятки раз активнее норадреналина);
Стимулирует солевой аппетит и жажду.
Таким образом, эта система приводит АД к норме при его снижении. Избыток ангиотензина II влияет на сердце, так же как и избыток КА и тромбоксанов, вызывает гипертрофию и фиброз миокарда, способствует гипертонии и хронической сердечной недостаточности.
При повышении АД начинают работать в основном три гормона: НУП (натрийуретические пептиды), дофамин, адреномедуллин. Их эффекты противоположны эффектам альдостерона и АТ II. НУП вызывают экскрецию Na + , Cl - , H 2 O, вазодилатацию, увеличивают проницаемость сосудов и снижают образование ренина.
Адреномедуллин действует так же, как НУП: это экскреция Na + , Cl - , H 2 O, вазодилатация. Дофамин синтезируется проксимальными канальцами почек, действует как паракринный гормон. Его эффекты: экскреция Na + и Н 2 О. Дофамин снижает синтез альдостерона, действие ангиотензина II и альдостерона, вызывает вазодилатацию и увеличение почечного кровотока. В совокупности эти эффекты приводят к снижению АД.
Уровень артериального давления зависит от многих факторов: работы сердца, тонуса периферических сосудов и их эластичности, а также от объёма электролитного состава и вязкости циркулирующей крови. Всё это контролируется нервной и гуморальной системой. Гипертоническая болезнь в процессе хронизации и стабилизации связана с поздними (ядерными) эффектами гормонов. При этом возникают ремоделирование сосудов, их гипертрофия и пролиферация, фиброз сосудов и миокарда.
В настоящее время эффективными гипотензивными лекарствами являются ингибиторы вазопептидаз АПФ и нейтральной эндопептидазы. Нейтральная эндопептидаза участвует в разрушении брадикинина, НУП, адреномедуллина. Все три пептида являются вазодилататорами, снижают АД. Например, ингибиторы АПФ (периндо-, эналоприл) снижают АД, уменьшая образование АТ II и задерживая распад брадикинина.
Открыты ингибиторы нейтральной эндопептидазы (омапатрилат), являющиеся одновременно ингибиторами АПФ и нейтральной эндопептидазы. Они не только снижают образование АТ II, но и предотвращают распад гормонов, снижающих АД - адреномедуллина, НУП, брадикинина. Ингибиторы АПФ не полностью выключают РААС. Более полного выключения этой системы можно достигнуть блокаторами рецепторов ангиотензина II (лозартан, эпросартан).
Для цитирования:
Леонова М.В. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему // РМЖ. Медицинское обозрение. 2013. №17. С. 886
Роль ренин-ангиотензин-альдостероновой системы (РААС) в развитии артериальной гипертонии (АГ) и других сердечно-сосудистых заболеваний в настоящее время считается главенствующей. В кардиоваскулярном континууме АГ находится среди факторов риска, а главным патофизиологическим механизмом поражения сердечно-сосудистой системы является ангиотензин II (АТII). АТII является ключевым компонентом РААС - эффектором, который реализует вазоконстрикцию, задержку натрия, активацию симпатической нервной системы, клеточную пролиферацию и гипертрофию, развитие оксидативного стресса и процессов воспаления сосудистой стенки.
В настоящее время уже получили развитие и широкое клиническое применение два класса препаратов, блокирующих РААС, - ингибиторы АПФ и блокаторы рецепторов АТII. Фармакологические и клинические эффекты этих классов имеют отличия. АПФ является пептидазой из группы цинк-металлопротеиназ, которая метаболизирует АТI, АТ1-7, брадикинин, субстанцию Р и многие другие пептиды . Механизм действия ингибиторов АПФ главным образом связан с предотвращением образования АТII, что способствует вазодилатации, натрийурезу и устраняет провоспалительный, пролиферативный и другие эффекты АТII. Кроме того, ингибиторы АПФ препятствуют деградации брадикинина и повышают его уровень. Брадикинин - мощный вазодилататор, он потенцирует натрийурез, а главное - обладает кардиопротективным (предотвращает гипертрофию, уменьшает ишемическое повреждение миокарда, улучшает коронарное кровоснабжение) и вазопротективным действием, улучшая эндотелиальную функцию. Вместе с тем, высокий уровень брадикинина - причина развития ангионевротического отека, что является одним из серьезных недостатков ингибиторов АПФ, которые значительно повышают уровень кининов.
Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» - образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ .
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы - неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин - фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрий-уретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) . Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома .
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида .
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате - к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 .
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием - ингибиторы вазопептидаз (табл. 2, рис. 1) .
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат - 8,9:0,5; фазидоприлат - 5,1:9,8; сампатрилат - 8,0:1,2 . В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ .
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов . Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла - 2,17% против 0,68% (относительный риск 3,4) . Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина .
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, - илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП . При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона . Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4-8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6-12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно . По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1-1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) . Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат - блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 - LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства . В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. . Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ . Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка - маркер повышения активности натрий-уретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования . Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А-тип рецепторов происходит вазоконстрикция, а через В-тип - вазодилатация . В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация . Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов . Первый неселективный антагонист рецепторов эндотелина - бозентан - в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла . Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии . В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана . Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 . Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание - лечение легочной гипертензии.
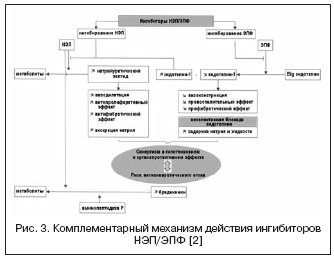
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу - ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) . Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрий-уретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований . В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пер-оральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, - алискирен - был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24-40 ч), внепочечный путь элиминации . Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150-300 мг/сут приводил к снижению САД на 8,7-13 и 14,1-15,8 мм рт.ст. соответственно и ДАД - на 7,8-10,3 и 10,3-12,3 мм рт.ст. . Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) , регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) . Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.



Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.
И превращается в проренин путём отщепления 23 аминокислот . В эндоплазматическом ретикулуме проренин подвергается гликозилированию и приобретает 3-D структуру, которая характерна для аспартатных протеаз . Готовая форма проренина состоит из последовательности включающей 43 остатка присоединённых к N-концу ренина, содержащего 339-341 остаток . Предполагается, что дополнительная последовательность проренина (prosegment) связана с ренином для предотвращения взаимодействия с ангиотензиногеном. Большая часть проренина свободно выбрасывается в системный кровоток путём экзоцитоза , но некоторая доля превращается в ренин путём действия эндопептидаз в секреторных гранулах юкстагломерулярных клеток. Ренин , образуемый в секреторных гранулах в дальнейшем выделяется в кровоток, но этот процесс жёстко контролируется давлением , ангиотензином 2, NaCl, через внутриклеточные концентрации ионов кальция. Поэтому у здоровых людей объём циркулирующего проренина в десять раз выше концентрации активного ренина в плазме. Однако, все же остаётся не понятным, почему концентрация неактивного предшественника настолько высока.
Контроль секреции ренина
Активная секреция ренина регулируется четырьмя независимыми факторами:
- Почечным барорецепторным механизмом в афферентной артериоле, который улавливает изменение почечного перфузионного давления.
- Изменениями уровня NaCl в дистальном отделе нефрона. Этот поток измеряется как изменение концентрации Cl - клетками плотного пятна дистального извитого канальца нефрона в области, прилегающей к почечному тельцу.
- Стимуляцией симпатическими нервами через бета-1 адренергические рецепторы.
- Механизмом отрицательной обратной связи, реализованным через прямое действие ангиотензина 2 на юкстагломерулярные клетки.
Секрецию ренина активирует снижение перфузионного давления или уровня NaCl и повышение симпатической активности. Ренин также синтезируется и в других тканях, включая мозг, надпочечник, яичники, жировая ткань, сердце и сосудах.
Контроль секреции ренина - определяющий фактор активности РААС.
Механизм действия ренин-ангиотензиновой системы
Ренин регулирует начальный, ограничивающий скорость, этап РААС путём отщепления N-концевого сегмента ангиотензиногена для формирования биологически инертного декапептида ангиотензина 1 или Ang-(1-10). Первичный источник ангиотензиногена - печень . Долговременный подъём уровня ангиотензиногена в крови , который происходит во время беременности , при синдроме Иценко-Кушинга или при лечении глюкокортикоидами , может вызвать гипертензию , хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина . Неактивный декапептид Ang 1 гидролизуется в клетках эндотелия лёгочных капилляров ангиотензинпревращающим ферментом (АПФ) , который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 , биологически активный, мощный вазоконстриктор. АПФ представляет собой экзопептидазу и секретируется главным образом лёгочным и почечным эндотелием, нейроэпителиальными клетками . Ферментативная активность АПФ заключается в повышении вазоконстрикции и снижении вазодилятации.
Новые данные о компонентах ренин-ангиотензиновой системы
Хотя Ang2 наиболее биологически активный продукт РААС, существуют данные, что другие метаболиты агиотензинов 1 и 2 могу также могут иметь значительную активность. Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путём отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов , например, в мозге и почках. Ang 3 , гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу , вызываемое действием этих ангиотензинов на AT1-рецептор . Причём этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора. Пептиды , получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом АПФ, названным АПФ2) конкретно на Ang2. В отличие от АПФ, АПФ2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определённые рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. АПФ2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
Рецепторы ангиотензина II
Описаны как минимум 4 подтипа рецепторов к ангиотензину .
- Первый тип AT1-R участвует в реализации наибольшего числа установленных физиологических и патофизиологических функций ангиотензина 2. Действие на сердечно-сосудистую систему (вазоконстрикция , повышение давления крови, повышение сократимости сердца , сосудистая и сердечная гипертония), действие на почки (реабсорбция Na+, ингибирование выделения ренина), симпатическую нервную систему , надпочечника (стимуляция синтеза альдостерона). AT1-R рецетор также является посредником во влиянии ангиотензина на клеточный рост , пролиферацию, воспалительные реакции, и оксидативный стресс . Этот рецептор связан с G-белком и содержит семь встроенных в мембрану последовательностей. AT1-R широко представлен во многих типах клеток, являющихся мишенью Ang 2.
- Второй тип AT2-R широко представлен в период эмбрионального развития мозга , почек затем же в период постнатального развития количество этого рецептора падает. Имеются данные, что, несмотря на низкий уровень экспрессии во взрослом организме, AT2 рецептор может выступать в качестве посредника в процессе вазодилятации и также оказывать антипролиферативный и антиапоптотичекие эффекты в гладких мышцах сосудов и угнетать рост кардиомиоцитов . В почках, как предполагается, активация AT2 влияет на реабсорбцию в проксимальных извитых канальцах и стимулировать реакции превращения простагландина E2 в простагландин F2α.2,7. Однако, важность некоторых из этих At2 связанных действий остаётся неизученной.
- Функции третьего типа (AT3) рецепторов не до конца изучены.
- Четвёртый тип рецепторов (AT4) участвует в выделении ингибитора активатора плазминогена (под действием ангиотензина 2, а также 3 и 4). Предполагается, что эффекты характерные для Ang 1-7, включая вазодилятацию, натрийурез, снижение пролиферации, и защита сердца, реализуются через уникальные рецепторы, которые не связываются с Ang 2, такими как MAS рецепторы.
Также нужно отметить, что последние данные указывают на существование высокоаффинных поверхностных рецепторов, которые связывают как ренин, так и проренин. Они находятся в тканях мозга, сердца, плаценты и почек (в поэндотелиальной гладкой мускулатуре и мезангие). Эффекты таких рецепторов направлены на локальное увеличение выработки Ang2 и запуска внеклеточных киназ, таких как, MAP -киназ, к которым относится ERK1 и ERK2. Эти данные пролили свет на Ang2-независимые механизмы клеточного роста, активируемые ренином и проренином.
Влияние на прочие секреции
Как отмечалось ранее Ang2, через AT1 рецепторы стимулирует выработку альдостерона клубочковой зоной надпочечника. Альдостерон наиболее важный регулятор K+- Na+ баланса и таким образом играет важную роль в контроле объёма жидкостей. Он увеличивает реабсорцию натрия и воды в дистальных извитых канальцах и собирательных трубочках (а также в толстой кишке и слюнных и потовых железах) и таким образом вызывает экскрецию ионов калия и водорода. Ангиотензин 2 вместе с внеклеточным уровнем ионов калия - наиболее значимые регуляторы альдостерона, но синтез Ang2 также может быть вызван АКТГ, норадреналином, эндотелином, серотонином, а ингибирован АНП и NO. Также важно отметить, что Ang 2 важный фактор трофики клубочковой зоны надпочечников, которая без его наличия может атрофироваться.
Ренин
Ренин - протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль афферентных (приносящих) артериол почечного тельца. Секрецию ренина стимулирует падение давления в приносящих артериолах клубочка, вызванное уменьшением АД и снижением концентрации Na + . Секрецию ренина также способствует снижение импульсации от барорецепторов предсердий и артерий в результате уменьшения АД. Секрецию ренина ингибирует Ангиотензин II, высокое АД.
В крови ренин действует на ангиотензиноген.
Ангиотензиноген - α 2 -глобулин, из 400 АК. Образование ангиотензиногена происходит в печени и стимулируется глюкокортикоидами и эстрогенами. Ренин гидролизует пептидную связь в молекуле ангиотензиногена, отщепляя от него N-концевой декапептид -ангиотензин I , не имеющий биологической активности.
Под действием антиотензин-превращающего фермента (АПФ) (карбоксидипептидилпептидазы) эдотелиальных клеток, лёгких и плазмы крови, с С-конца ангиотензина I удаляются 2 АК и образуется ангиотензин II (октапептид).
Ангиотензин II
Ангиотензин II функционирует через инозитолтрифосфатную систему клеток клубочковой зоны коры надпочечников и ГМК. Ангиотензин II стимулирует синтез и секрецию альдостерона клетками клубочковой зоны коры надпочечников. Высокие концентрации ангиотензина II вызывают сильное сужение сосудов периферических артерий и повышают АД. Кроме этого, ангиотензин II стимулирует центр жажды в гипоталамусе и ингибирует секрецию ренина в почках.
Ангиотензин II под действием аминопептидаз гидролизуется в ангиотензин III (гептапептид, с активностью ангиотензина II, но имеющий в 4 раза более низкую концентрацию), который затем гидролизуется ангиотензиназами (протеазы) до АК.
Альдостерон
Альдостерон - активный минералокортикостероид, синтезирующийся клетками клу-бочковой зоны коры надпочечников.
Синтез и секрецию альдостерона стимулируют ангиотензин II , низкая концентрация Na + и высокая концентрацией К + в плазме крови, АКТГ, простагландины. Секрецию альдостерона тормозит низкая концентрация К + .
Рецепторы альдостерона локализованы как в ядре, так и в цитозоле клетки. Альдостерон индуцирует синтез: а) белков-транспортёров Na + , переносящих Na + из просвета канальца в эпителиальную клетку почечного канальца; б) Na + ,К + -АТФ-азы в) белков-транспортёров К + , переносящих К + из клеток почечного канальца в первичную мочу; г) митохондриальных ферментов ЦТК, в частности цитратсинтазы, стимулирующих образование молекул АТФ, необходимых для активного транспорта ионов.
В результате альдостерон стимулирует реабсорбцию Na + в почках, что вызывает задержку NaCl в организме и повышает осмотическое давление.
Альдостерон стимулирует секрецию К + , NH 4 + в почках, потовых железах, слизистой оболочке кишечника и слюнных железах.
3. Схема регуляции водно-солевого обмена Роль системы раас в развитии гипертонической болезни
Гиперпродукция гормонов РААС вызывает повышение объема циркулирующей жидкости, осмотического и артериального давления, и ведет к развитию гипертонической болезни.
Повышение ренина возникает, например, при атеросклерозе почечных артерий, который возникает у пожилых.
Гиперсекреция альдостерона – гиперальдостеронизм , возникает в результате нескольких причин.
Причиной первичного гиперальдостеронизма (синдром Конна ) примерно у 80% больных является аденома надпочечников, в остальных случаях - диффузная гипертрофия клеток клубочковой зоны, вырабатывающих альдостерон.
При первичном гиперальдостеронизме избыток альдостерона усиливает реабсорбцию Na + в почечных канальцах, что служит стимулом к секреции АДГ и задержке воды почками. Кроме того, усиливается выведение ионов К + ,Mg 2+ и Н + .
В результате развиваются: 1). гипернатриемия, вызывающая гипертонию, гиперволемию и отёки; 2). гипокалиемия, ведущая к мышечной слабости; 3). дефицит магния и 4). лёгкий метаболический алкалоз.
Вторичный гиперальдостеронизм встречается гораздо чаще, чем первичный. Он может быть связан с сердечной недостаточностью, хроническими заболеваниями почек, а также с опухолями, секретирующие ренин. У больных наблюдают повышенный уровень ренина, ангиотензина II и альдостерона. Клинические симптомы менее выражены, чем при первичном альдостеронизе.
КАЛЬЦИЙ, МАГНИЙ, ФОСФОРНЫЙ ОБМЕН
Функции кальция в организме:
Внутриклеточный посредник ряда гормонов (инозитолтрифосфатная система);
Участвует в генерации потенциалов действия в нервах и мышцах;
Участвует в свертывании крови;
Запускает мышечное сокращение, фагоцитоз, секрецию гормонов, нейромедиаторов и т.д.;
Участвует в митозе, апоптозе и некробиозе;
Увеличивает проницаемость мембраны клеток для ионов калия, влияет на натриевую проводимость клеток, на работу ионных насосов;
Кофермент некоторых ферментов;
Функции магния в организме:
Является коферментом многих ферментов (транскетолаз (ПФШ), глюкозо-6ф дегидрогеназы, 6-фосфоглюконат дегидрогеназы, глюконолактон гидролазы, аденилатциклазы и т.д.);
Неорганический компонент костей и зубов.
Функции фосфата в организме:
Неорганический компонент костей и зубов (гидроксиаппатит);
Входит в состав липидов (фосфолипиды, сфинголипиды);
Входит в состав нуклеотидов (ДНК, РНК, АТФ, ГТФ, ФМН, НАД, НАДФ и т.д.);
Обеспечивает энергетический обмен т.к. образует макроэргические связи (АТФ, креатинфосфат);
Входит в состав белков (фосфопротеины);
Входит в состав углеводов (глюкозо-6ф, фруктозо-6ф и т.д.);
Регулирует активность ферментов (реакции фосфорилирования / дефосфорилирования ферментов, входит в состав инозитолтрифосфата – компонента инозитолтрифосфатной системы);
Участвует в катаболизме веществ (реакция фосфоролиза);
Регулирует КОС т.к. образует фосфатный буфер. Нейтрализует и выводит протоны с мочой.
Распределение кальция, магния и фосфатов в организме
У взрослого человека содержится в среднем 1000г кальция:
Кости и зубы содержат 99% кальция. В костях 99% кальция находится в виде малорастворимого гидроксиапатита [Са 10 (РО 4) 6 (ОН) 2 Н 2 О], а 1% - в виде растворимых фосфатов;
Внеклеточная жидкость 1%. Кальций плазмы крови представлен в виде: а). свободных ионов Са 2+ (около 50%); б). ионов Са 2+ соединённых с белками, главным образом, с альбумином (45%); в) недиссоциирующих комплексов кальция с цитратом, сульфатом, фосфатом и карбонатом (5%). В плазме крови концентрация общего кальция составляет 2, 2-2,75 ммоль/л, а ионизированного - 1,0-1,15 ммоль/л;
Внутриклеточная жидкость содержит кальция в 10000-100000 раз меньше чем внеклеточной жидкости.
Во взрослом организме содержится в около 1кг фосфора:
Кости и зубы содержат 85% фосфора;
Внеклеточная жидкость – 1% фосфора. В сыворотке крови концентрация неорганического фосфора – 0,81-1,55 ммоль/л, фосфора фосфолипидов 1,5-2г/л;
Внутриклеточная жидкость – 14% фосфора.
Концентрация магния в плазме крови 0,7-1,2 ммоль/л.
Обмен кальция, магния и фосфатов в организме
С пищей в сутки должно поступать кальция - 0,7-0,8г, магния - 0,22-0,26г, фосфора – 0,7-0,8г. Кальций всасывается плохо на 30-50%, фосфор хорошо – на 90%.
Помимо ЖКТ, кальций, магний и фосфор поступают в плазму крови из костной ткани, в процессе ее резорбции. Обмен между плазмой крови и костной тканью по кальцию составляет 0,25-0,5г/сут, по фосфору – 0,15-0,3г/сут.
Выводится кальций, магний и фосфор из организма через почки с мочой, через ЖКТ с калом и через кожу с потом.
Регуляция обмена
Основными регуляторами обмена кальция, магния и фосфора являются паратгормон, кальцитриол и кальцитонин.
Паратгормон
Паратгормон (ПТГ) - полипептид, из 84 АК (около 9,5 кД), синтезируется в паращитовидных железах.
Секрецию паратгормона стимулирует низкая концентрация Са 2+ ,Mg 2+ и высокая концентрация фосфатов, ингибирует витамин Д 3 .
Скорость распада гормона уменьшается при низкой концентрации Са 2+ и увеличивается, если концентрация Са 2+ высока.
Паратгормон действует на кости и почки . Он стимулирует секрецию остеобластамиинсулиноподобного фактора роста 1 и цитокинов , которые повышают метаболическую активностьостеокластов . В остеокластах ускоряется образованиещелочной фосфатазы и коллагеназы , которые вызывают распад костного матрикса, в результате чего происходит мобилизация Са 2+ и фосфатов из кости во внеклеточную жидкость.
В почках паратгормон стимулирует реабсорбцию Са 2+ ,Mg 2+ в дистальных извитых канальцах и уменьшает реабсорбцию фосфатов.
Паратгормон индуцирует синтез кальцитриола (1,25(OH) 2 D 3).
В результате паратгормон в плазме крови повышает концентрацию Са 2+ иMg 2+ , и снижает концентрацию фосфатов.
Гиперпаратиреоз
При первичном гиперпаратиреозе (1:1000) нарушается механизм подавления секреции паратгормона в ответ на гиперкальциемию. Причинами могут быть опухоль (80%), диффузная гиперплазия или рак (менее 2%) паращитовидной железы.
Гиперпаратиреоз вызывает:
разрушение костей , при мобилизации из них кальция и фосфатов. Увеличивается риск переломов позвоночника, бедренных костей и костей предплечья;
гиперкальциемию , при усилении реабсорбции кальция в почках. Гиперкальциемия приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляются общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц;
образования в почках камней при увеличение концентрации фосфата и Са 2+ в почечных канальцах;
гиперфосфатурию и гипофосфатемию , при снижении реабсорбции фосфатов в почках;
Вторичный гиперпаратиреоз возникает при хронической почечной недостаточности и дефиците витамина D 3 .
При почечной недостаточности угнетается образование кальцитриола, что нарушает всасывание кальция в кишечнике и приводит к гипокальциемии . Гиперпаратиреоз возникает в ответ на гипокальциемию, но паратгормон не способен нормализовать уровень кальция в плазме крови. Иногда возникает гиперфостатемия. В следствие повышения мобилизации кальция из костной ткани развивается остеопороз.
Гипопаратиреоз
Гипопаратиреоз обусловлен недостаточностью паращитовидных желёз и сопровождается гипокальциемией. Гипокальциемия вызывает повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
Кальцитриол
Кальцитриол синтезируется из холестерола.

В коже под влиянием УФ-излучения из 7-дегидрохолестерола образуется большая часть холекальциферола (витамина Д 3). Небольшое количество витамина Д 3 поступает с пищей. Холекальциферол связывается со специфическим витамин Д-связывающим белком (транскальциферином), поступает в кровь и переносится в печень.
В печени 25-гидроксилаза гидроксилирует холекальциферол в кальцидиол (25-гидроксихолекальциферол, 25(OH)Д 3). D-связывающий белок транспортирует кальцидиол в почки.
В почках митохондриальная 1α-гидроксилаза гидроксилирует кальцидиол в кальцитриол (1,25(OH) 2 Д 3), активную форму витамина Д 3 . Индуцирует 1α-гидроксилазу паратгормон.
Синтез кальцитриола стимулирует паратгормон, низкая концентрация фосфатов и Са 2+ (через паратгормон) в крови.
Синтез кальцитриола ингибирует гиперкальциемия, она активирует 24α-гидроксилазу , которая превращает кальцидиол в неактивный метаболит 24,25(OH) 2 Д 3 , при этом соответственно активный кальцитриол не образуется.
Кальцитриол воздействует на тонкий кишечник, почки и кости.
Кальцитриол:
в клетках кишечника индуцирует синтез Са 2+ -переносящих белков, которые обеспечивают всасывание Са 2+ , Mg 2+ и фосфатов;
в дистальных канальцах почек стимулирует реабсорбцию Са 2+ , Mg 2+ и фосфатов;
при низком уровне Са 2+ увеличивает количество и активность остеокластов, что стимулирует остеолиз;
при низком уровне паратгормона, стимулирует остеогенез.
В результате кальцитриол повышает в плазме крови концентрацию Са 2+ , Mg 2+ и фосфатов.
При дефиците кальцитриола нарушается образование аморфного фосфата кальция и кристаллов гидроксиапатитов в костной ткани, что приводит к развитию рахита и остеомаляции.
Рахит - заболевание детского возраста, связанное недостаточной минерализацией костной ткани.
Причины рахита : недостаток витамина Д 3 , кальция и фосфора в пищевом рационе, нарушение всасывания витамина Д 3 в тонком кишечнике, снижением синтеза холекальциферола из-за дефицита солнечного света, дефект 1а-гидроксилазы, дефект рецепторов кальцитриола в клетках-мишенях. Снижение концентрации в плазме крови Са 2+ стимулирует секрецию паратгормона, который через остеолиз вызывает разрушение костной ткани.
При рахите поражаются кости черепа; грудная клетка вместе с грудиной выступает вперёд; деформируются трубчатые кости и суставы рук и ног; увеличивается и выпячивается живот; задерживается моторное развитие. Основные способы предупреждения рахита - правильное питание и достаточная инсоляция.
Кальцитонин
Кальцитонин - полипептид, состоит из 32 АК с одной дисульфидной связью, секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз.
Секрецию кальцитонина стимулирует высокая концентрация Са 2+ и глюкагона, подавляет низкая концентрация Са 2+ .
Кальцитонин:
подавляет остеолиз (снижая активность остеокластов) и ингибирует высвобождение Са 2+ из кости;
в канальцах почек тормозит реабсорбцию Са 2+ , Mg 2+ и фосфатов;
тормозит пищеварение в ЖКТ,
Изменения уровня кальция, магния и фосфатов при различных патологиях
Снижение концентрации Са 2+
беременности;
алиментарной дистрофии;
рахите у детей;
остром панкреатите;
закупорке желчевыводящих путей, стеаторее;
почечной недостаточности;
вливание цитратной крови;
Повышение концентрации Са 2+ в плазме крови наблюдается при:
переломы костей;
полиартриты;
множественные миеломы;
метастазы злокачественных опухолей в кости;
передозировка витамина Д и Са 2+ ;
механическая желтуха;
Снижение концентрации фосфатов в плазме крови наблюдается при:
гиперфункции паращитовидных желез;
остеомаляции;
почечный ацидоз
Повышение концентрации фосфатов в плазме крови наблюдается при:
гипофункции паращитовидных желез;
передозировка витамина Д;
почечной недостаточности;
диабетическом кетоацидозе;
миеломной болезни;
остеолизе.
Концентрация магния часто пропорциональна концентрации калия и зависит от общих причин.
Повышение концентрации Mg 2+ в плазме крови наблюдается при:
диабетическом ацидозе;
тиреотоксикозе;
хроническом алкоголизме.
распаде тканей;
инфекциях;
Роль микроэлементов: Mg 2+ , Mn 2+ , Co , Cu , Fe 2+ , Fe 3+ , Ni , Mo , Se , J . Значение церулоплазмина, болезнь Коновалова-Вильсона.
Марганец – кофактор аминоацил-тРНК синтетаз.
Биологическая роль Na + , Cl - , K + , HCO 3 - - основных электролитов, значение в регуляции КОС. Обмен и биологическая роль. Анионная разность и ее коррекция.
Тяжелые металлы (свинец, ртуть, медь, хром и др.), их токсическое действие.
Повышение содержание хлоридов в сыворотке крови : обезвоживание, острая почечная недостаточность, метаболический ацидоз после диареи и потери бикарбонатов, респираторный алкалоз, травма головы, гипофункция надпочечников, при длительном приеме кортикостероидов, тиазидный диуретиков, гиперальдостеронизм, болезнь Кушенга.
Снижение содержания хлоридов в сыворотке крови : алкалоз гипохлоремический (после рвоты), ацидоз респираторный, избыточное потоотделение, нефрит с потерей солей (нарушение реабсорбции), травма головы, состояние с увеличением объема внеклеточной жибкости, калит язвенный, болезнь Аддисона (гипоальдостеронизм).
Повышенное выделение хлоридов с мочой : гипоальдостеронизм (болезнь Аддисона), нефрит с потерей солей, повышенный прием соли, лечение диуретиками.
Снижение выведения хлоридов с мочой : Потеря хлоридов при рвоте, диареи, болезнь Кушинга, терминальная фаза почечной недостаточности, ретенция соли при образовании отеков.
Выделение кальция с мочой в норме 2,5-7,5 ммоль/сут.
Повышение содержание кальция в сыворотке крови : гиперпаратиреоз, метастазы опухолей в костную ткань, миеломная болезнь, сниженное выделение кальцитонина, передозировка витамина Д, тиреотоксикоз.
Снижение содержания кальция в сыворотке крови : гипопаратиреоз, увеличение выделения кальцитонина, гиповитаминоз Д, нарушение реабсорбции в почках, массивная гемотрансфузия, гипоальбунемия.
Повышенное выделение кальция с мочой : длительное воздействие солнечных лучей (гипервитаминоз Д), гиперпаратиреоз, метастазы опухолей в костную ткань, нарушение реабсорбции в почках, тиреотоксикоз, остеопороз, лечение глюкокортикоидами.
Снижение выведения кальция с мочой : гипопаратиреоз, рахит, острый нефрит (нарушение фильтрации в почках), гипотериоз.
Повышение содержание железа в сыворотке крови : апластическая и гемолитическая анемии, гемохроматоз, острый гепатит и стеатоз, цирроз печени, талассемия, повторные трансфузии.
Снижение содержания железа в сыворотке крови : железодефицитная анемия, острые и хронические инфекции, опухоли, заболевания почек, кровопотеря, беременность, нарушение всасывания железа в кишечнике.
играет центральную роль в развитии ренальной гипертензии. Любое повреждение паренхимы почек (склероз, кисты, рубцы, микроангиопатические повреждения, тубуло- интерстициальное или гломерулярное воспаление) вызывает нарушение перфузии гломерул и повышает секрецию ренина.
Гиперренинемия ведет к ангиотензин II-зависимой вазоконстрикции, а также альдостерон-зависимой задержке натрия. Таким образом, повышается и общее периферическое сопротивление, и объем циркулирующей крови. У 90% больных с тХПН АГ носит объем- зависимый характер и у 10% ведущим является повышение активности РАС. Кроме того, высокий уровень ангиотензина II запускает процессы воспаления, гипертрофии миокарда, эндотелиального повреждения, пролиферацию мезангиальных клеток и интерстициальный фиброз.
Существенное влияние на объем внеклеточной жидкости и АД оказывает не контролируемое потребление натрия с пищей. Задержка натрия при ХБП может быть обусловлена как снижением СКФ, так и повышением его реабсорбции в канальцах, не зависящим и не зависящим от активации РААС (при гломерулонефритах с нефротическим синдромом).
У детей с АГ на диализе диурез обычно меньше, чем у нормотензивных пациентов того же возраста, а междиализная прибавка веса умеренно коррелирует с междиализным повышением АД (r=0,41). Нефрэктомия у детей на диализе с ренинзависимой АГ снижает среднее АД, а гипертензия приобретает объем-зависимый характер.
Важным механизмом АГ является повышение активности симпатической нервной системы, отмечающееся у больных с ХБП и особенно при ХПН. Лежащие в основе этого феномена механизмы пока не ясны и могут включать афферентные сигналы от почек, допаминергические нарушения и аккумуляцию лептина. Не только блокада b-рецепторов, но и ингибиция ангиотензин- превращающего фермента (АПФ) может уменьшать симпатическую гиперактивацию при ХБП. Представляется, что ренальная ишемия любого происхождения (в том числе локальная) вызывает симпатическую гиперактивацию.
Препараты, используемые в терапии больных при ХБП, могут вызывать ятрогенную артериальную гипертензию. Например, применение эритропоэтина в течение нескольких недель приводит к подъему АД у 20% больных. Глюкокортикоиды вызывают задержку жидкости за счет их минералокортикоидной активности. Циклоспорин А вызывает повышение гломерулярных афферентных артериол и гиперплазии юкстагломерулярного аппарата с последующим повышенным высвобождением ренина и ангиотензина II.
Таким образом, все дети с ХБП находятся в группе риска по развитию АГ. К группе высокого риска относятся больные с тХПН, реципиенты почечного трансплантата, больные с быстропрогрессирующим гломерулонефритом.
Ранняя диагностика АГ представляется чрезвычайно важной задачей для предупреждения отдаленных последствий гипертензии. С этой целью необходимо применение активных скрининговых методов, так как клинические симптомы АГ часто отсутствуют.
Простейшим скрининговым методом выявления АГ является регулярное измерение артериального давления, по меньшей мере, при каждом осмотре пациента врачом. Диагноз АГ правомерен, если не менее чем при 3-х клинических измерениях АД выше 95 перцентиля для данного возраста и роста. (Приложение 1.). В настоящее время широкое распространение получил метод 24-часового (суточного) мониторирования артериального давления (СМАД).
Это исследование позволяет диагностировать «скрытую гипертензию», т.е. не выявляемую при разовых клинических измерениях АД, например, в ночное время, исключить гипертензию «белого халата», которая встречается даже у детей, длительно находящихся в стационаре. В последнем случае целесообразно проведение СМАД амбулаторно, когда ребенок на протяжении исследования находится в привычной ему домашней обстановке.
Проведение СМАД показано всем детям с ХБП ежегодно. В случае выявления АГ необходимо также проведение офтальмологического осмотра (для оценки состояния сосудов сетчатки) и эхокардиографии (для исключения систолической и диастолической дисфункции, оценки степени гипертрофии миокарда). В дальнейшем эти исследования должны выполняться не реже 1 раза в год.
Основной целью антигипертензивной терапии является предупреждение повреждения органов-мишеней (особенно гипертрофии левого желудочка) и замедление прогрессирования ХБП. Всем детям с ХБП, осложненной АГ, показана антигипертензивная терапия до достижения уровня АД ниже 90 перцентиля для данного возраста и роста.
Терапия АГ включает в себя коррекцию образа жизни и диеты и медикаментозное лечение.
В рационе детей с ХБП, осложненной АГ, прежде всего, необходимо ограничить потребление натрия до 1-2 г/сут. Пища готовится без добавления соли, которая выдается дозировано для досаливания еды в тарелке, должны быть исключены все продукты с высоким содержанием натрия (консервы, колбасные изделия, ржаной хлеб и т.п.). Такого рода ограничения часто тяжело переносятся пациентами, но, неконтролируемое потребление натрия значительно снижает эффективность медикаментозной антигипертензивной терапии.
Ожирение не характерно для детей с ХБП и обычно связано с лечением стероидами. Постепенное снижение массы тела на фоне низкокалорийной диеты и дозированных физических нагрузок способствует нормализации АД. На практике применение низкокалорийной диеты затруднено из-за уже имеющихся у детей с ХБП диетических ограничений, и она редко оказывается эффективной. Тем не менее, у тучных детей с задержкой натрия может быть полезна комбинированная низкокалорийная диета с пониженным содержанием натрия.
У больных с АГ, получающих ЗПТ, изменение диализного режима может улучшить контроль АД до начала фармакологического лечения. В большинстве случаев, у диализных больных можно добиться нормализации показателей АД адекватной продолжительностью диализа, тщательным контролем баланса внеклеточной жидкости, более агрессивным достижением сухого веса. Считается, что сокращение натрия в диете в сочетании с низким натрием в диализате сравнимо по эффективности с увеличением диализного времени и позволяет добиться умеренного снижения АД.
На всех стадиях ХБП основой антигипертензивной терапии является фармакологическое лечение. Контроль АД ниже 90 перцентиля может быть достигнут монотерапией не более чем у 75% детей с ХБП 2-ой стадии. У остальных больных необходимо применение 2-х и более лекарственных препаратов. У детей с тХПН трудно достичь адекватного контроля АД, у 50% детей на диализе наблюдается неконтролируемая гипертензия.
У детей с АГ рекомендуется начинать лечение с одного препарата в низкой или средней терапевтической дозе и постепенно повышать ее до достижения контроля АД. При отсутствии достаточного эффекта от монотерапии показано использование комбинации из 2-х и более препаратов. Исключение - неотложные состояния при АГ, такие как гипертонический криз, гипертоническая энцефалопатия, когда лечение следует начинать с внутривенного введения препаратов до достижения клинического эффекта.
В настоящее время в терапии артериальной гипертензии используется широкий спектр лекарственных средств (Табл.2.1).
В первую очередь применяются препараты следующих групп:
· Ингибиторы ангиотензин-превращающего фермента (иАПФ)
· Блокаторы рецепторов к ангиотензину II (БРА)
· Блокаторы кальциевых каналов
· β - адреноблокаторы
· диуретики
К препаратам резерва относятся:
· α β – адреноблокаторы
· центральные α – антагонисты
· периферические α - антагонисты
· периферические вазодилататоры.
У детей с хронической патологией почек начинать терапию наиболее целесообразно с иАПФ или БРА. Эти препараты не только обладают гипотензивным действием, но и замедляют прогрессирование почечной недостаточности более эффективно, чем препараты других фармакологических групп. Ренопротективный эффект блокады РААС обусловлен снижением внутриклубочковой гипертензии путем избирательной дилатации эфферентной артериолы, снижением протеинурии, а также ослаблением провоспалительного и просклеротического действия ангиотензина II. Дополнительный эффект блокады РААС заключается в снижении симпатической гиперактивности.
Поскольку протеинурия является независимым фактором прогрессирования ХБП, пациенты с ХБП и протеинурией должны получать блокаторы РААС даже при отсутствии АГ. Не выявлено отчетливых преимуществ применения БРА перед иАПФ. Если протеинурия сохраняется на фоне монотерапии, то возможно применение комбинации иАПФ и БРА, так как это сочетание эффективно для уменьшения протеинурии и замедления прогрессирования ХБП.
Применение ингибиторов АПФ и БРА противопоказано пациентам со снижением СКФ ≤ 20 мл/мин, при гиперкалиемии, и при двустороннем стенозе почечных артерий. При назначении препаратов этих групп детям с ХБП 3-4 стадии необходимо контролировать уровень азотемии и калия после начала терапии и при каждом повышении дозы. Терапия комбинацией иАПФ и БРА повышает риск падения клубочковой фильтрации и гиперкалиемии. У детей с ХПН целесообразным может быть применение фозиноприла (моноприла), т.к. этот препарат (в отличие от других и АПФ) метаболизируется в основном в печени, а не выводится с мочой и более безопасен для больных с существенным нарушением почечных функций. Отмечено, что кашель, индуцированный иАПФ, у детей встречается реже, чем у взрослых; при возникновении этого побочного эффекта возможна замена иАПФ на БРА.
b-блокаторы – препараты второй линии для лечения детей с почечной гипертензией. b-блокаторы должны с осторожностью использоваться при сердечной недостаточности, а также у больных сахарным диабетом из-за негативных метаболических эффектов. Неселективные b-блокаторы противопоказаны при заболеваниях легких, сопровождающихся бронхообструкцией. У грудных детей хороший эффект оказывает назначение пропранолола. Ретардированная форма этого препарата позволяет назначать его 1 раз в день у старших детей. Предпочтительнее назначение селективных b1-блокаторов, например атенолола, который также обладает пролонгированным действием.
Применение b-блокаторов показано при наличии симптомов гиперактивации симпатической нервной системы: тахикардии, вазоконстрикции, высокого сердечного.
Блокаторы кальциевых каналов (БКК) используются как дополнительная терапия у детей с резистентной гипертензией. Дигидропиридиновые препараты (нифедипин, амлодипин и т.д.) действуют главным образом как вазодилататоры. Дозы амлодипина разработаны для педиатрии и не требуют коррекции в зависимости от почечной функции, однако дигидропиридиновые БКК (нифедипин) повышают внутриклубочковое давление и могут повышать протеинурию, не оказывая, следовательно, ренопротективного действия. Недигидропиридиновые БКК (производные фенилалкиламина - верапамил, бензодиазепина - дилтиазем) обладают дополнительным антипротеин- урическим эффектом.
В исследованиях у пожилых больных с сахарным диабетом 2 типа, недигдропиридиновые БКК показали себя как действенное средство в снижении протеинурии и АД и замедлении прогрессирование ХБП, их эффективность в этом отношении оказалась сравнима с иАПФ - лизиноприлом. Поскольку среди детей подобных исследований не проводилось, в детском возрасте недигдропиридиновые БКК должны применяться с осторожностью, учитывая их побочные эффекты (удлинение интервала PQ, брадиаритмии).
В исследованиях у больных с сахарным диабетом, АГ и протеинурией комбинация иАПФ с дигидропиридиновым БКК III поколения – манидипином - оказывала дополнительный антипротеинурический эффект по сравнению с монотерапией иАПФ. Показано благоприятное воздействие манидипина на почечную гемодинамику и протеинурию.
Внутривенное введение никардипина является методом выбора для лечения гипертонического криза, особенно в тех случаях, когда почечная функция не известна или быстро изменяется. Этот препарат может безопасно использоваться даже у очень маленьких детей с АГ.
Диуретики показаны, прежде всего, пациентам с задержкой натрия, гиперволемией и отеками и не являются препаратами первой линии в терапии АГ у детей с ХБП. Необходимо помнить, что тиазидные диуретики становятся малоэффективными при СКФ








